题目内容
8.下列化学用语不正确的是( )| A. | 氯乙烯的结构简式:CH2CHCl | B. | 乙醇的分子式:C2H6O | ||
| C. | 苯的结构简式: | D. | 羟基的电子式: |
分析 A、碳碳双键不能省略;
B、乙醇分子由2个碳原子、6个H原子和1个O原子构成;
C、 是苯的结构简式中的凯库勒式;
是苯的结构简式中的凯库勒式;
D、羟基中氧原子有一个未成对电子.
解答 解:A、碳碳双键不能省略,而氯乙烯中两个碳原子之间有一条碳碳双键,故氯乙烯的结构简式为CH2=CHCl,故A错误;
B、乙醇分子由2个碳原子、6个H原子和1个O原子构成,故乙醇的分子式为C2H6O,故B正确;
C、 是苯的结构简式中的凯库勒式,即苯的结构简式可以写为
是苯的结构简式中的凯库勒式,即苯的结构简式可以写为 ,故C正确;
,故C正确;
D、羟基中氧原子有一个未成对电子,故羟基的电子式为 ,故D正确.
,故D正确.
故选A.
点评 本题考查了常见的化学用语,应注意区分结构式、结构简式、分子式、电子式等常见化学用语的区别,难度不大.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
18.某研究小组利用图装置探究CO还原Fe2O3所得到的一种黑色粉末的成分(固定装置略去).(已知:Fe2+遇到K3溶液生成蓝色沉淀)

请回答问題:
(1)按气流方向,各仪器接口从左到右的连接顺序为:
i→c→d→g→h→a→b→j→k→f→e.(填字母编号)
(2)证明Fe2O3己被还原的现象是F中的固体由红棕色变黑色,C中溶液变浑浊.
(3)研究小组对黑色粉末的成分提出下列猜想:
【猜想一】黑色粉末的成分可能是Fe.
【猜想二】黑色粉末的成分可能是FeO.
【猜想三】黑色粉末的成分可能是Fe3O4.
设计并完成实验如表:
①根据实验现象,则猜想三成立.
②研究小组又向步骤3的溶液中滴加新制氯水,发现溶液红色褪去.可能的原因及验证方法为假设SCN-被Cl2氧化,向溶液中加入KSCN溶液,若出现红色,则假设成立.
(4)上述装置还有不妥之处,改进措施为在整套装置的尾气出口处,放置一燃着的酒精灯(或用导管将尾气引至F处酒精灯点燃).

请回答问題:
(1)按气流方向,各仪器接口从左到右的连接顺序为:
i→c→d→g→h→a→b→j→k→f→e.(填字母编号)
(2)证明Fe2O3己被还原的现象是F中的固体由红棕色变黑色,C中溶液变浑浊.
(3)研究小组对黑色粉末的成分提出下列猜想:
【猜想一】黑色粉末的成分可能是Fe.
【猜想二】黑色粉末的成分可能是FeO.
【猜想三】黑色粉末的成分可能是Fe3O4.
设计并完成实验如表:
| 步骤 | 操作 | 现象 |
| 1 | 加入稀盐酸 | 溶解,无气泡 |
| 2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 |
②研究小组又向步骤3的溶液中滴加新制氯水,发现溶液红色褪去.可能的原因及验证方法为假设SCN-被Cl2氧化,向溶液中加入KSCN溶液,若出现红色,则假设成立.
(4)上述装置还有不妥之处,改进措施为在整套装置的尾气出口处,放置一燃着的酒精灯(或用导管将尾气引至F处酒精灯点燃).
19.下列化学用语正确的是( )
| A. | 氯化钠的电子式  | B. | 乙炔的结构式 H-C=C-H | ||
| C. | 磷原子的结构示意图  | D. | 氨的分子式 NH3 |
16. 化学反应速率与限度与生产、生活密切相关
化学反应速率与限度与生产、生活密切相关
(1)A学生为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
①反应速率最大的时间段是(指0~1、1~2、2~3、3~4、4~5 )2~3 min,原因是因该反应放热,随着反应,溶液温度升高,故反应速率加快.
②求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率0.1mol/(L•min).(设溶液体积不变)
(2)B学生也做同样的实验,但由于反应太快,测不准氢气体积,故想办法降低反应速率,请你帮他选择在盐酸中加入下列AB以减慢反应速率.(填写代号)
A.蒸馏水 B.冰块 C.HNO3溶液 D.CuSO4溶液
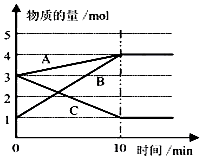
(3)某温度下在10L密闭容器中,3种气态物质A、B、C的物质的量随时间变化曲线如图.
①该反应的化学方程式是2C?A+3B.
②求在该条件达到反应的限度(平衡状态)时反应物的转化率【转化率=$\frac{转化的物质的量}{初始物质的量}$×100%】,请写出计算过程,计算结果保留1位小数)
 化学反应速率与限度与生产、生活密切相关
化学反应速率与限度与生产、生活密切相关(1)A学生为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
②求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率0.1mol/(L•min).(设溶液体积不变)
(2)B学生也做同样的实验,但由于反应太快,测不准氢气体积,故想办法降低反应速率,请你帮他选择在盐酸中加入下列AB以减慢反应速率.(填写代号)
A.蒸馏水 B.冰块 C.HNO3溶液 D.CuSO4溶液
(3)某温度下在10L密闭容器中,3种气态物质A、B、C的物质的量随时间变化曲线如图.
①该反应的化学方程式是2C?A+3B.
②求在该条件达到反应的限度(平衡状态)时反应物的转化率【转化率=$\frac{转化的物质的量}{初始物质的量}$×100%】,请写出计算过程,计算结果保留1位小数)
3.下列微粒中:①13Al3+② ③
③ ④F-,其核外电子数相同的是( )
④F-,其核外电子数相同的是( )
 ③
③ ④F-,其核外电子数相同的是( )
④F-,其核外电子数相同的是( )| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |
13.CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都同属于离子型碳化物.请通过对CaC2制C2H2的反应进行思考,从中得到必要的启示,判断下列反应产物 不正确的是( )
| A. | ZnC2水解生成C2H2 | B. | A14C3水解生成C3H4 | ||
| C. | Mg2C3水解生成C3H4 | D. | Li2C2水解生成C2H2 |
20.化学与生活密切相关,下列说法正确的是( )
| A. | SO2可用于杀菌、消毒 | |
| B. | 汽车尾气中含有大量大气污染物,这是汽油不完全燃烧造成的 | |
| C. | 碘是人体必需微量元素,所以要多吃富含髙磷酸的食物 | |
| D. | 海水淡化的方法主要有蒸馏法、电解法、离子交换法等 |
17.制出了第一张元素周期表的科学家是( )
| A. | 勒夏特列 | B. | 汤姆生 | C. | 阿伏伽德罗 | D. | 门捷列夫 |
18.下列物质一定属于同系物的是( )
①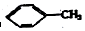 ②
②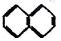 ③
③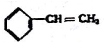 ④C2H4 ⑤CH2=CH-CH=CH2 ⑥C2H6 ⑦
④C2H4 ⑤CH2=CH-CH=CH2 ⑥C2H6 ⑦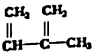 ⑧
⑧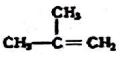
①
 ②
② ③
③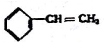 ④C2H4 ⑤CH2=CH-CH=CH2 ⑥C2H6 ⑦
④C2H4 ⑤CH2=CH-CH=CH2 ⑥C2H6 ⑦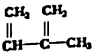 ⑧
⑧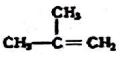
| A. | ④和⑧ | B. | ①、②和③ | C. | ⑤、⑦和⑧ | D. | ⑥和⑧ |