题目内容
18.下列说法正确的是( )| A. | 实验室可用Na2SO3与浓H2SO4反应制备SO2 | |
| B. | 用澄清石灰水可鉴别CO2和SO2 | |
| C. | Na2SO3长期放置空气中容易变质 | |
| D. | SO2通入BaCl2溶液中能产生白色沉淀 |
分析 A、用Na2SO3与浓H2SO4反应制备SO2是应强酸制弱酸和不挥性的酸制挥发性的酸的原理;
B、CO2和SO2与澄清石灰水都变浑浊;
C、亚硫酸盐具有极强的还原性;
D、二 氧化硫与氯化钡不反应.
解答 解:A、实验室应强酸制弱酸和不挥性的酸制挥发性的酸的原理,用Na2SO3与浓H2SO4反应制备SO2,故A正确;
B、CO2和SO2与澄清石灰水都变浑浊,现象相同,所以不能用澄清石灰水可鉴别CO2和SO2,故B错误;
C、亚硫酸盐具有极强的还原性,长期放置空气中被氧化成硫酸钠而变质,故C正确;
D、二 氧化硫与氯化钡不反应,所以SO2通入BaCl2溶液中不能产生白色沉淀,故D错误;
故选AC.
点评 本题考查二氧化硫的性质和制备,明确发生的氧化还原反应是解答本题的关键,其中CO2和SO2与澄清石灰水都变浑浊,现象相同,题目难度不大.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案
相关题目
8.相同条件下,某气体对H2的相对密度为17,则该气体是( )
| A. | CO2 | B. | CO | C. | SO2 | D. | H2S |
6.下列溶液能用来区分SO2和CO2气体的是( )
| A. | 澄清石灰水 | B. | 双氧水 | C. | 酸性高锰酸钾 | D. | 氯化钡溶液 |
13.等质量的钠、镁、铝分别与等量的稀硫酸反应,金属均过量,生成的氢气是( )
| A. | 钠最多 | B. | 镁最多 | C. | 铝最多 | D. | 一样多 |
3.Na2FeO4是一种高效多功能水处理剂,既能消毒杀菌,又能除去悬浮物杂质.一种制备Na2FeO4的方法为2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑,下列有关说法正确的是( )
| A. | 在反应中氧化剂是Na2O2,还原剂是FeSO4 | |
| B. | 生成2molNa2FeO4时,反应中共有8mol电子转移 | |
| C. | 反应中生成22.4LO2时,共有10mol电子转移 | |
| D. | Na2FeO4净水过程中,既有氧化还原反应发生,又有非氧化还原反应发生 |
6.下列对一些实验事实的理论解释正确的是( )
| 选项 | 实验事实 | 理论解释 |
| A | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
| B | 足球烯(C60)在苯中的溶解度大 | 足球烯是原子晶体 |
| C | 金刚石的熔点低于石墨 | 金刚石是分子晶体,石墨是原子晶体 |
| D | HF的沸点高于HCl | HF的相对分子质量小于HCl |
| A. | A | B. | B | C. | C | D. | D |
3.已知:H-H、N-H、N≡N的键能分别为436KJ/mol,391KJ/mol,946KJ/mol,则:3H2(g)+N2(g)═2NH3(g)△H(KJ/mol)为( )
| A. | +92 | B. | -345.3 | C. | -92 | D. | +345.3 |
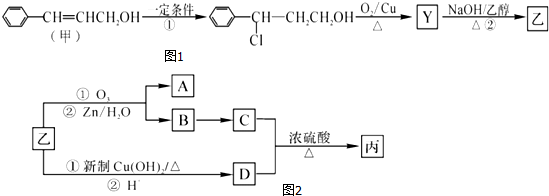
 .
. ;
;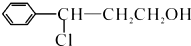 →Y:
→Y: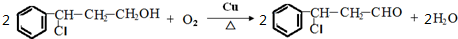 .
. .
.