题目内容
9.在体积为V L的密闭容器中,通入气体CO a mol和O2b mol,点燃充分反应后,容器中碳原子和氧原子数之比为$\frac{a}{a+2b}$.分析 无论CO和氧气是否完全反应,但密闭容器中各种元素原子个数不变,根据原子守恒计算反应后容器内C、O原子的物质的量,据此解答.
解答 解:由元素守恒可知,反应后容器内n(C)=n(CO)=amol、n(O)=n(CO)+2n(O2)=(a+2b)mol,故充分反应后,容器内碳原子个数与氧原子个数之比为$\frac{a}{a+2b}$,故答案为:$\frac{a}{a+2b}$.
点评 本题考查化学方程式计算,侧重对质量守恒定律考查,注意理解质量守恒定律的宏观与微观意义,利用原子的个数在反应前后不变来解答题,比较基础.

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
20.据报道,在西藏冻土的一定深度下,发现了储量巨大的“可燃冰”,它主要是甲烷和水形成的化合物(CH4•nH2O).
(1)在常温常压下,“可燃冰”会发生分解反应,其化学方程式是CH4•nH2O=CH4↑+nH2O.
(2)甲烷可制成合成气(CO、H2),再制成甲醇(CH3OH),代替日益供应紧张的燃油.
①在101KPa时,1.6g CH4(g)与H2O(g)反应生成CO、H2,吸热20.64kJ.则甲烷与H2O(g)反应的热化学方程式CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.4 kJ•mol-1.
②CH4不完全燃烧也可制得合成气:CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H=-35.4kJ•mol-1,则从原料选择和能源利用角度,比较方法①和②,合成甲醇的适宜方法为②(填序号).
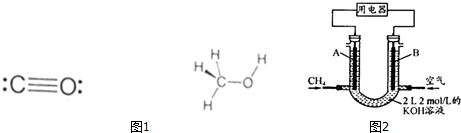
(3)利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇(CH3OH),发生的主要反应如下:CO和甲醇的结构式如图1所示:
①CO(g)+2H2(g)=CH3OH(g)△H1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)=CO(g)+H2O(g)△H3
回答下列问题:
已知反应①中相关的化学键键能数据如下:
由此计算△H1=-99kJ•mol-1,已知△H2=-58kJ•mol-1,则△H3=+41kJ•mol-1.
(4)可燃冰中CH4的其它用途是能源和燃料,将CH4设计成燃料电池,其利用率更高,装置示意如图2(A、B为多孔性碳棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL.当44.8L<V≤89.6L时,负极电极反应为CH4-8e-+9CO32-+3H2O=10HCO3-.
(1)在常温常压下,“可燃冰”会发生分解反应,其化学方程式是CH4•nH2O=CH4↑+nH2O.
(2)甲烷可制成合成气(CO、H2),再制成甲醇(CH3OH),代替日益供应紧张的燃油.
①在101KPa时,1.6g CH4(g)与H2O(g)反应生成CO、H2,吸热20.64kJ.则甲烷与H2O(g)反应的热化学方程式CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.4 kJ•mol-1.
②CH4不完全燃烧也可制得合成气:CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H=-35.4kJ•mol-1,则从原料选择和能源利用角度,比较方法①和②,合成甲醇的适宜方法为②(填序号).
(3)利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇(CH3OH),发生的主要反应如下:CO和甲醇的结构式如图1所示:

①CO(g)+2H2(g)=CH3OH(g)△H1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)=CO(g)+H2O(g)△H3
回答下列问题:
已知反应①中相关的化学键键能数据如下:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
(4)可燃冰中CH4的其它用途是能源和燃料,将CH4设计成燃料电池,其利用率更高,装置示意如图2(A、B为多孔性碳棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL.当44.8L<V≤89.6L时,负极电极反应为CH4-8e-+9CO32-+3H2O=10HCO3-.
17.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 25℃,1.01×l05Pa,46gNO2中含有的分子数等于NA | |
| B. | 7.8gNa2O2含有的阴离子数目为0.2NA | |
| C. | 2.0g重水(D2O)中含有的质子数和中子数均为NA | |
| D. | 标况下,1.12LC12溶于水,转移0.05NA电子 |
4.已知在3.2g某气体中所含的分子数目约为3.01×1022,此气体的摩尔质量为( )
| A. | 32g | B. | 32g/mol | C. | 64 mol | D. | 64g/mol |
14.下列关于化学键的说法中,正确的是( )
| A. | 凡含离子键的化合物,一定含金属元素 | |
| B. | 金属元素与非金属元素间一定形成离子键 | |
| C. | 构成单质分子的微粒一定含有共价键 | |
| D. | 由非金属元素组成的化合物不一定是共价化合物 |
1.生活中常常涉及到一些有机化合物的知识.下列叙述中正确的是( )
| A. | 将米饭在嘴中多加咀嚼就会变甜 | |
| B. | 羊毛和棉花的主要成分都是纤维素 | |
| C. | 为提高加酶洗衣粉的去污能力,应使用热水进行洗涤 | |
| D. | 未成熟的苹果遇碘水会变蓝,是因为其中含有淀粉 |
18.下列说法正确的是( )
| A. | 实验室可用Na2SO3与浓H2SO4反应制备SO2 | |
| B. | 用澄清石灰水可鉴别CO2和SO2 | |
| C. | Na2SO3长期放置空气中容易变质 | |
| D. | SO2通入BaCl2溶液中能产生白色沉淀 |
 ,其空间结构为正四面体;乙烯的结构简式为CH2=CH2,乙烯通入溴水中的化学方程式为CH2=CH2+Br2→CH2Br-CH2Br,,其反应类型为加成反应,C5H12的烃有3种同分异构体
,其空间结构为正四面体;乙烯的结构简式为CH2=CH2,乙烯通入溴水中的化学方程式为CH2=CH2+Br2→CH2Br-CH2Br,,其反应类型为加成反应,C5H12的烃有3种同分异构体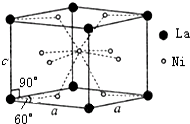 材料的开发、应用和发展是科技进步的结果,同时,材料的发展也促进了科技的进步和发展.
材料的开发、应用和发展是科技进步的结果,同时,材料的发展也促进了科技的进步和发展. .
.