题目内容
3.已知:H-H、N-H、N≡N的键能分别为436KJ/mol,391KJ/mol,946KJ/mol,则:3H2(g)+N2(g)═2NH3(g)△H(KJ/mol)为( )| A. | +92 | B. | -345.3 | C. | -92 | D. | +345.3 |
分析 化学反应中,化学键断裂吸收能量,形成新化学键放出能量,反应热=吸收的总能量-放出的总能量.
解答 解:反应热=化学键断裂吸收的总能量-化学键形成放出的总能量,所以1mol N2生成2mol NH3的反应热=946kJ+3×436 kJ-2×3×391kJ=-92kJ,故选C.
点评 本题考查反应热的计算,题目难度不大,注意把握从键能的角度计算反应热的方法.

练习册系列答案
相关题目
17.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 25℃,1.01×l05Pa,46gNO2中含有的分子数等于NA | |
| B. | 7.8gNa2O2含有的阴离子数目为0.2NA | |
| C. | 2.0g重水(D2O)中含有的质子数和中子数均为NA | |
| D. | 标况下,1.12LC12溶于水,转移0.05NA电子 |
18.下列说法正确的是( )
| A. | 实验室可用Na2SO3与浓H2SO4反应制备SO2 | |
| B. | 用澄清石灰水可鉴别CO2和SO2 | |
| C. | Na2SO3长期放置空气中容易变质 | |
| D. | SO2通入BaCl2溶液中能产生白色沉淀 |
18.某羧酸酯的分子式为C18H26O5,1mol该酯完全水解可得到2mol乙酸和1mol醇,该醇的分子式为( )
| A. | C14H18O5 | B. | C14H22O3 | C. | C14H22O5 | D. | C14H10O5 |
8.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 2.4g金属镁所含电子数目为0.2NA | B. | 16gCH4所含原子数目为NA | ||
| C. | 17g NH3所含质子数为10 NA | D. | 18g水所含分子数目为18NA |
 .请根据图回答:
.请根据图回答:
 .
. ; ②CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O.
; ②CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O.
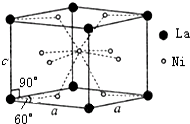 材料的开发、应用和发展是科技进步的结果,同时,材料的发展也促进了科技的进步和发展.
材料的开发、应用和发展是科技进步的结果,同时,材料的发展也促进了科技的进步和发展.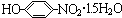 .
. ,Y
,Y ,Z
,Z ,W
,W .
.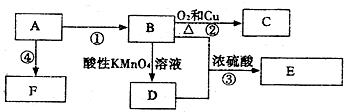
 ,C的名称乙醛,
,C的名称乙醛,