题目内容
6.将含有Mg、Al、Fe的合金15.5g放入足量的NaOH溶液中,在标准状况下收集到3.36L气体;再将等质量的该合金加入到足量的稀H2SO4溶液中,在标准状况下收集到8.96L气体,继续在该溶液中加入足量的NaOH溶液,产生沉淀的质量为( )| A. | 35.9g | B. | 30.8g | C. | 28.1g | D. | 无法计算 |
分析 将含有Mg、Al、Fe的合金15.5g放入足量的NaOH溶液中,在标准状况下收集到3.36L气体即氢气,根据氢气的物质的量为0.15mol,可求出铝的物质的量为0.1mol,质量为2.7g;从而得出混合物中镁和铁的质量之和为15.5g-2.7g=12.8g.
再将等质量的该合金加入到足量的稀H2SO4溶液中,在标准状况下收集到8.96L气体即0.4mol氢气,而由于铝和碱、酸反应生成氢气的物质的量相同,故镁和铁生成的氢气的物质的量为0.4mol-0.15mol=0.25mol.
设镁的物质的量为xmol,铁的物质的量为ymol
根据两者的质量之和为12.8g可得:24x+56y=12.8g①
根据两者生成的氢气的物质的量共为0.25mol可得:x+y=0.25mol②
解①②可得x和y.从而即可得出生成的沉淀Mg(OH)2和Fe(OH)3的质量.
解答 解:将含有Mg、Al、Fe的合金15.5g放入足量的NaOH溶液中,只有铝能和氢氧化钠溶液反应,在产生的标准状况下3.36L气体是铝和氢氧化钠溶液反应生成的,且物质的量为n=$\frac{3.36L}{22.4L/mol}$=0.15mol,而1mol铝~1.5mol氢气,设铝的物质的量为xmol,则有:
1molAl~1.5molH2
xmol 0.15mol
故有:$\frac{1}{xmol}=\frac{1.5mol}{0.15mol}$,解得x=0.1mol
故混合物中铝的质量m=nM=0.1mol×27g/mol=2.7g;
则可知混合物中镁和铁的质量之和为15.5g-2.7g=12.8g.
再将等质量的该合金加入到足量的稀H2SO4溶液中,在标准状况下收集到8.96L气体即0.4mol氢气,而由于铝和碱、酸反应生成氢气的物质的量相同,故镁和铁生成的氢气的物质的量为0.4mol-0.15mol=0.25mol.
设镁的物质的量为xmol,铁的物质的量为ymol
根据两者的质量之和为12.8g可得:24x+56y=12.8g①
根据两者生成的氢气的物质的量共为0.25mol可得:x+y=0.25mol②
解①②可得x=0.0375mol y=0.2125mol
继续向溶液中滴加氢氧化钠,则最终生成的沉淀为Mg(OH)2和Fe(OH)3,质量为28.1g,
故选C.
点评 本题考查了有关金属和酸、碱的计算,应抓住等量的铝无论是和酸反应还是和碱反应生成的氢气的量是相同的来计算,综合性较强.

 阅读快车系列答案
阅读快车系列答案方案Ⅰ:铜铝混合物 $→_{充分反应}^{足量溶液A}$测定生成气体的体积
方案Ⅱ:铜铝混合物 $→_{充分反应}^{足量溶液B}$ 测定剩余固体的质量
下列有关判断中不正确的是( )
| A. | 溶液A和B均可以是盐酸或NaOH溶液 | |
| B. | 若溶液B选用浓H2SO4,反应条件需要加热,剩余固体为铝 | |
| C. | 溶液A和B均不可选用稀HNO3 | |
| D. | 实验室中方案Ⅱ更容易实施 |
| A. | 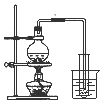 制取少量蒸馏水 | B. |  制取少量NO2 | ||
| C. | 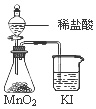 比较MnO2、Cl2、I2的氧化性 | D. |  量取8.50mL的 稀硫酸 |
| A. | 1molO2参加反应转移电子数一定为4NA | |
| B. | 一定条件下,足量铜与2 mol的浓硫酸充分反应,转移电子数为2NA | |
| C. | 300mL2mol/L乙醇溶液中所含乙醇分子数为0.6NA | |
| D. | 标准状况下,22.4L氦气与22.4L氟气所含原子数均为2NA |
| A. | 在c(CO32-)=0.1 mol•L-1的溶液中:K+、AlO2-、Cl-、NO3- | |
| B. | 在常温下由水电离出的c(OH-)=1×10-12 mol•L-1的溶液中:Fe2+、ClO-、Na+、SO42- | |
| C. | 在加入苯酚会显紫色的溶液中:NH4+、Cl-、Na+、SCN- | |
| D. | 在能使蓝色石蕊试纸变红的溶液中:S2O32-、CO32-、Na+、K+ |
| A. | 通入CO2气体产生蓝色沉淀 | |
| B. | 该溶液中Na+、NH4+、NO3-、Mg2+可以大量共存 | |
| C. | 与H2S反应的离子方程式:Cu2++S2-=CuS↓ | |
| D. | 与过量浓氨水反应的离子方程式:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+ |
步骤一:电解精制:
请回答以下问题:
电解时,阴极上的电极反应式为Cu2++2e=Cu;
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:

(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式:3Ag+4H++NO3-=3Ag++NO↑+2H2O.
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
| 序号 | 反应 | 平衡常数 |
| 1 | Au+6HNO3(浓)═Au(NO3)3+3NO2↑+3H2O | <<1 |
| 2 | Au3++4Cl-═AuCl4- | >>1 |
(2)滤液含量的测定:
以下是该小组探究滤液的一个实验流程:

则100ml滤液中Fe2+的浓度为0.1mol•L-1.



 反应E→G的方程式为:HOOC(CH2)4COOH+2NaHCO3→NaOOC(CH2)4COONa+2CO2↑+2H2O.
反应E→G的方程式为:HOOC(CH2)4COOH+2NaHCO3→NaOOC(CH2)4COONa+2CO2↑+2H2O.
 .
. ,反应类型是酯化反应(或取代反应).
,反应类型是酯化反应(或取代反应). .
.