题目内容
1.用NA表示阿伏加德罗常数的数值,下列判断正确的是( )| A. | 1molO2参加反应转移电子数一定为4NA | |
| B. | 一定条件下,足量铜与2 mol的浓硫酸充分反应,转移电子数为2NA | |
| C. | 300mL2mol/L乙醇溶液中所含乙醇分子数为0.6NA | |
| D. | 标准状况下,22.4L氦气与22.4L氟气所含原子数均为2NA |
分析 A、氧气反应后的价态可能为-1价,还可能为-2价;
B、铜只能和浓硫酸反应,和稀硫酸不反应;
C、求出乙醇的物质的量,然后根据分子个数N=nNA来分析;
D、氦气为单原子分子,氟气为双原子分子.
解答 解:A、氧气反应后的价态可能为-1价,还可能为-2价,故1mol氧气反应后转移的电子可能为4NA个,还可能为2NA个,故A错误;
B、铜只能和浓硫酸反应,和稀硫酸不反应,故浓硫酸不能反应完全,则转移的电子数小于2NA个,故B错误;
C、溶液中乙醇的物质的量n=CV=2mol/L×0.3L=0.6mol,故分子个数N=nNA=0.6NA个,故C正确;
D、氦气为单原子分子,氟气为双原子分子,故标况下22.4L氦气和氟气即1mol氦气和氟气所含的原子个数不同,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
11.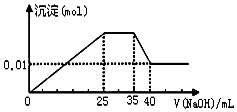 某无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+,NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
某无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+,NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
①第一份加足量AgNO3溶液后,有白色沉淀产生.
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99g.
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图
根据上述实验,以下推测不正确的是( )
 某无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+,NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
某无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+,NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:①第一份加足量AgNO3溶液后,有白色沉淀产生.
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99g.
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图
根据上述实验,以下推测不正确的是( )
| A. | 依据电荷守恒,原溶液中NO3-的物质的量应为0.03mol | |
| B. | 原溶液一定不存在H+、Cu2+、CO32- | |
| C. | 原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n(NH4+)=1:1:2 | |
| D. | 实验所加的NaOH的浓度为2mol•L-1 |
12.下列各曲线分别表示元素的某种性质与核电荷的关系的变化趋势(Z是核电荷数,Y是元素的有关性质)

下列说法中不正确的是( )

下列说法中不正确的是( )
| A. | 图乙中Y表示ⅡA元素的价电子数 | |
| B. | 图丁中Y表示ⅦA元素氢化物的沸点 | |
| C. | 图丙中Y表示第三周期元素的最高正化合价 | |
| D. | 图甲中Y表示F-、Na+、Mg2+、Al3+四种离子的半径 |
9.北大和中科院的化学工作者合作已成功研制出碱金属与C60形成的球碳盐K3C60实验测知该物质属于离子化合物,且有良好的超导性,下列关于K3C60的组成和结构的分析正确的是( )
| A. | K3C60中既有离子键,又有极性键 | |
| B. | 该物质在熔融状态下能导电 | |
| C. | 该物质的化学式写成KC20 | |
| D. | 1mol K3C60中含有的离子键的数目为3NA个 |
16.如表是元素周期表的一部分.X、Y、Z、W均为短周期主族元素.下列说法可能正确的是( )
| X | Y | ||
| Z | W |
| A. | 元素的最高化合价Z大于Y | |
| B. | 元素的气态氢化物的稳定性W强于Y | |
| C. | 原子半径Z比Y小 | |
| D. | 元素的最高价氧化物的水化物酸性X大于W |
