题目内容
8.短周期主族元素W、X、Y、Z 的原子序数依次增大,W、X 原子的最外层电子数之比为4:3,Z 原子比X 原子的核外电子数多4.下列说法正确的是( )| A. | W、Y、Z 的电负性大小顺序一定是Z>Y>W | |
| B. | Z 的氢化物分之间存在氢键 | |
| C. | Y、Z 形成的分子的中心原子可能采用sp3杂化 | |
| D. | WY2分子中σ键与π键的数目之比是2:1 |
分析 短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4:3,由于为主族元素,最外层电子数不能为8,故W、X最外层电子数分别为4、3,且X原子序数较大,故W处于第二周期,X处于第三周期,则W为C元素、X为Al元素;Z原子比X原子的核外电子数多4,则Z为Cl,Y为Al到Cl之间的元素,据此进行解答.
解答 解:短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4:3,由于为主族元素,最外层电子数不能为8,故W、X最外层电子数分别为4、3,且X原子序数较大,故W处于第二周期,X处于第三周期,则W为C元素、X为Al元素,Z原子比X原子的核外电子数多4,则Z为Cl,Y为Al到Cl之间的元素.
A.同主族自上而下电负性减弱,Y若为Si元素,则电负性C>Si,故A错误;
B.Z为Cl元素,氯化氢分子中不存在氢键,故B错误;
C.Y、Cl形成的分子可以为SiCl4,四氯化硅为正四面体构型,中心原子Si可能采用sp3杂化,故C正确;
D.WY2分子应为CS2,其结构式为S=C=S,分子中δ键与π键的数目之比是1:1,故D错误;
故选C.
点评 本题考查结构性质位置关系应用,涉及原子电负性、半径比较、化学键、分子结构等,推断元素是解题关键,注意Y元素的不确定性,题目难度中等.

练习册系列答案
相关题目
18.食品安全日益受到人们的关注.下列食品能食用的是( )
| A. | 使用瘦肉精饲养的猪 | B. | 用着色剂染色的馒头 | ||
| C. | 用硫酸铜浸泡过粽叶的粽子 | D. | 用食盐水浸泡过的菠萝 |
19.某研究性学习兴趣小组小诗、小坂两个同学为探究同周期元素性质递变规律时,他们准备了相关的实验用品(后面附:实验用品清单)并进行了任务分工.
小诗同学用不同的实验方法证明Na、Mg、Al的失电子能力的变化顺序,设计了如下方案,并记录了有关实验现象.
小坂同学为证明S、Cl得电子能力的变化顺序,事先也自行设计了一套实验方案:
附:实验用品清单
请根据上述材料,完成下列填空:
(1)请你为小诗、小坂两个同学核对所列的仪器清单中有没有缺少相关的仪器.
若有,则填“有”,并尽可能补全所缺少仪器的名称;若无,则填“无”有,试管;
(2)将与实验步骤对应的实验现象编号填写在下列表格中:
(3)写出镁与水反应的化学方程式:Mg+2H2O=Mg(OH)2+H2↑;
(4)小诗根据实验事实得出的实验结论是:金属活泼顺序为钠>镁>铝;
(5)请您帮忙小坂同学填写有关的实验现象和实验结论
小诗同学用不同的实验方法证明Na、Mg、Al的失电子能力的变化顺序,设计了如下方案,并记录了有关实验现象.
| 实验步骤 | 1将一小块金属钠放入滴有酚酞溶液的冷水中 2将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向试管中滴加酚酞溶液 3将镁条投入稀盐酸中 4将铝条投入稀盐酸中 |
| 实验现象 | A.剧烈反应,迅速生成大量的气体 B.浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红 C.反应不是很剧烈,产生无色气体 D.有气体产生,溶液变成浅红色 |
| 实验步骤 | 实验现象 | 实验结论 |
| 5.向新制Na2S溶液中滴加新制氯水 | 产生淡黄色沉淀 | 氯气的氧化性大于硫 |
| 试剂 | 金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlCl3溶液 |
| 仪器 | 表面皿,试管夹,镊子,小刀,玻璃片,砂纸 |
(1)请你为小诗、小坂两个同学核对所列的仪器清单中有没有缺少相关的仪器.
若有,则填“有”,并尽可能补全所缺少仪器的名称;若无,则填“无”有,试管;
(2)将与实验步骤对应的实验现象编号填写在下列表格中:
| 实验步骤 | 1 | 2 | 3 | 4 |
| 实验现象 | B | D | A | C |
(4)小诗根据实验事实得出的实验结论是:金属活泼顺序为钠>镁>铝;
(5)请您帮忙小坂同学填写有关的实验现象和实验结论
| 实验步骤 | 实验现象 | 实验结论 |
| 5、向新制Na2S溶液中滴加新制氯水 | 产生淡黄色沉淀 | 氯的氧化性大于硫 |
16.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 分别加热Na2CO3和NaHCO3固体 | 试管内壁都有水珠 | 两种物质均 受热分解 |
| B | 向FeSO4溶液中先滴入KSCN溶液再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
| C | 向漂白粉中滴入稀硫酸,将生成的气体通入品红溶液 | 品红溶液褪色 | 气体中含有Cl2 |
| D | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 还原性:Cl->I- |
| A. | A | B. | B | C. | C | D. | D |
3.下列有关比较中,大小顺序排列不正确的是( )
| A. | 热稳定性:HF>H2O>NH3>CH4 | |
| B. | 离子半径:S2->K+>Na+>Al3+ | |
| C. | 碱性:Mg(OH)2<KOH<CsOH | |
| D. | 给出质子的能力:H3PO4<H2SO4<HClO |
17.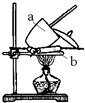 碳酸钠在不同温度下可以失去部分或全部的结晶水,现有一种碳酸钠晶体(Na2CO3•nH2O)样品,可采用在不同温度下加热样品(温度逐渐升高)来测定其组成.
碳酸钠在不同温度下可以失去部分或全部的结晶水,现有一种碳酸钠晶体(Na2CO3•nH2O)样品,可采用在不同温度下加热样品(温度逐渐升高)来测定其组成.
(1)某学生的实验流程如下:

①称量用的仪器是托盘天平,最小量度单位0.1g.
②如图为灼烧装置.下列对应仪器的名称中,若正确的在后面横线上写上“正确”,若错误请将正确名称写在后面横线上.
a.坩锅正确 b.三脚架泥三角
③流程中“操作”是指冷却,这一操作必须放在干燥器(填仪器名称)中进行.
④该学生停止实验的依据为连续两次称量的质量差不超过0.1g.
⑤实验结果记录如下:容器质量为33.6g
根据上表数据推算出n值,n=10.
(2)另有学生测定结果n值偏小,其可能的原因为b、c.
a.温度过高致少量碳酸钠分解了 b.碳酸钠晶体样品已有少量风化
c.碳酸钠晶体样品没有完全失去结晶水 d.加热过程中有少量晶体溅出.
 碳酸钠在不同温度下可以失去部分或全部的结晶水,现有一种碳酸钠晶体(Na2CO3•nH2O)样品,可采用在不同温度下加热样品(温度逐渐升高)来测定其组成.
碳酸钠在不同温度下可以失去部分或全部的结晶水,现有一种碳酸钠晶体(Na2CO3•nH2O)样品,可采用在不同温度下加热样品(温度逐渐升高)来测定其组成.(1)某学生的实验流程如下:

①称量用的仪器是托盘天平,最小量度单位0.1g.
②如图为灼烧装置.下列对应仪器的名称中,若正确的在后面横线上写上“正确”,若错误请将正确名称写在后面横线上.
a.坩锅正确 b.三脚架泥三角
③流程中“操作”是指冷却,这一操作必须放在干燥器(填仪器名称)中进行.
④该学生停止实验的依据为连续两次称量的质量差不超过0.1g.
⑤实验结果记录如下:容器质量为33.6g
| 称量次序 | 加热温度(℃) | 容器+试样质量(g) |
| Ⅰ | 常温 | 62.2 |
| Ⅱ | T1 | 56.8 |
| Ⅲ | T2 | 49.6 |
| Ⅳ | T3 | 44.2 |
| Ⅴ | T4 | 44.2 |
(2)另有学生测定结果n值偏小,其可能的原因为b、c.
a.温度过高致少量碳酸钠分解了 b.碳酸钠晶体样品已有少量风化
c.碳酸钠晶体样品没有完全失去结晶水 d.加热过程中有少量晶体溅出.
18.天津市场销售的某种食用精制盐包装袋上有如下说明:
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处):
1KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O
(2)上述反应生成的I2可用四氯化碳检验,向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.
①Na2SO3稀溶液与I2反应的离子方程式是I2+SO32-+H2O=2I-+SO42-+2H+.
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体.
以上设计中遗漏的操作及在上述步骤中的位置是在步骤b后,增加操作:将分液漏斗充分振荡后静置.
(3)已知:I2+2S2O32-═2I-+S4O62-.
某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol/L的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色.
②b中反应所产生的I2的物质的量是1.0×10-5mol.
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)$\frac{423}{w}$mg/kg.
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
1KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O
(2)上述反应生成的I2可用四氯化碳检验,向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.
①Na2SO3稀溶液与I2反应的离子方程式是I2+SO32-+H2O=2I-+SO42-+2H+.
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体.
以上设计中遗漏的操作及在上述步骤中的位置是在步骤b后,增加操作:将分液漏斗充分振荡后静置.
(3)已知:I2+2S2O32-═2I-+S4O62-.
某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol/L的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色.
②b中反应所产生的I2的物质的量是1.0×10-5mol.
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)$\frac{423}{w}$mg/kg.