题目内容
13.下列有关化学用语表示正确的是( )| A. | CO2的比例模型: | |
| B. | 氢氧根离子的电子式: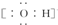 | |
| C. | 氯原子的结构示意图: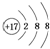 | |
| D. | 中子数为146、质子数为92的铀(U)原子:${\;}_{92}^{146}$U |
分析 A.碳原子与氧原子的大小是碳原子大.
B.阴离子的电子式要加括号,括号外写上带电荷的情况.
C.氯原子核外电子数与核内质子数应相等.
D.原子左上角代表质量数,左下角代表质子数.
解答 解:A.二氧化碳的比例模型,首先要在一条直线上,然后是中间大,两边小,碳原子半径大,画成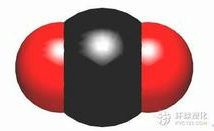 ,故A错误;
,故A错误;
B.阴离子的电子式是要加括号的,写成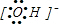 ,故B正确;
,故B正确;
C.氯原子没有得到电子,它的结构示意图为 ,故C错误;
,故C错误;
D.中子数与质子数相加等于质量数,此铀原子的原子符号为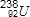 ,故D错误.
,故D错误.
故选B.
点评 在化学用语的考查中,比例模型要注意原子半径的大小,空间构型;阴阳离子电子式的区别;原子结构示意图与离子结构示意图的区别;同位素的表示方法.

练习册系列答案
相关题目
18.化学与生活密切相关,下列说法不正确的是( )
| A. | 铝壶可存放食醋 | B. | 乙烯可催熟水果 | C. | 硅胶可作干燥剂 | D. | 氯气可做消毒剂 |
2.土壤是人类赖以生存的最基本物质,以黏土为原料生产的产品伴随着人类文明的脚步.某兴趣小组以黏土为原料探究彩色水泥、轻质耐火材料的联合生产,其设计的流程如图所示.
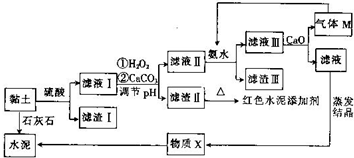
已知:黏土的主要成分为2CaO•3Al2O3•FeO•Fe2O3•10SiO2•nH2O.部分难溶物开始沉淀时和完全沉淀时的pH如表所示.
(1)为提高酸浸速率,除适当增大硫酸浓度外,还可采取的措施有搅拌、适当升温、将废渣碾细成粉末(任写一条).
(2)向滤液Ⅰ中加入H2O2的作用是将滤液中的Fe2+氧化为Fe3+;用CaCO3调节溶液pH约为3.3,其目的是使Fe3+完全转化为Fe(OH)3沉淀而除去.
(3)红色水泥添加剂的主要成分是Fe2O3.
(4)物质X的化学式为CaSO4•2H2O.
(5)气体M的电子式为 ;向滤液Ⅲ中加入CaO的作用是与水反应放热,降低NH3的溶解度(任写一条).
;向滤液Ⅲ中加入CaO的作用是与水反应放热,降低NH3的溶解度(任写一条).
(6)氮化铝广泛用于电子陶瓷等工业领域,以滤渣Ⅲ、碳及氮气为原料可制备氮化铝,用化学方程式表示制备过程:2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O、Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO.

已知:黏土的主要成分为2CaO•3Al2O3•FeO•Fe2O3•10SiO2•nH2O.部分难溶物开始沉淀时和完全沉淀时的pH如表所示.
| Fe(OH)2 | Fe(OH)3 | Al(OH)3 | |
| 开始沉淀时的pH | 6.3 | 1.9 | 3.4 |
| 完全沉淀时的pH | 8.3 | 3.2 | 4.7 |
(2)向滤液Ⅰ中加入H2O2的作用是将滤液中的Fe2+氧化为Fe3+;用CaCO3调节溶液pH约为3.3,其目的是使Fe3+完全转化为Fe(OH)3沉淀而除去.
(3)红色水泥添加剂的主要成分是Fe2O3.
(4)物质X的化学式为CaSO4•2H2O.
(5)气体M的电子式为
 ;向滤液Ⅲ中加入CaO的作用是与水反应放热,降低NH3的溶解度(任写一条).
;向滤液Ⅲ中加入CaO的作用是与水反应放热,降低NH3的溶解度(任写一条).(6)氮化铝广泛用于电子陶瓷等工业领域,以滤渣Ⅲ、碳及氮气为原料可制备氮化铝,用化学方程式表示制备过程:2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O、Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO.
3.下列图示且与对应的叙述不相符的是( )
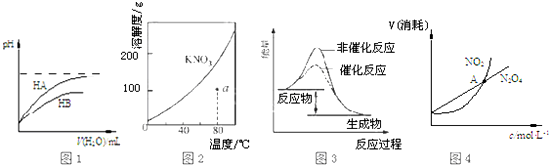

| A. | 图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH | |
| B. | 图2表示 KNO3的溶解度曲线,a点所示的溶液是80℃时KNO3的不饱和溶液 | |
| C. | 图3 表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| D. | 图4表示恒温恒容条件下,2NO2(g)?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 |