题目内容
3.下列图示且与对应的叙述不相符的是( )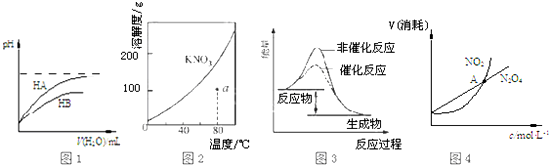
| A. | 图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH | |
| B. | 图2表示 KNO3的溶解度曲线,a点所示的溶液是80℃时KNO3的不饱和溶液 | |
| C. | 图3 表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| D. | 图4表示恒温恒容条件下,2NO2(g)?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 |
分析 A.稀释等pH的两种酸,稀释相同倍数时,pH变化越快的酸酸性越强,等浓度的钠盐溶液,弱酸的钠盐溶液pH大;
B.溶解度曲线上的点是饱和溶液,曲线以下的点是不饱和溶液来分析;
C.放热反应中反应物的总能量大于生成物的总能量,反应中加入催化剂会降低活化能,改变反应的速率,但反应热不改变;
D.可逆反应2NO2?N204(g)中,分析判断 二氧化氮消耗速率和四氧化二氮的消耗速率之比为2:1,说明反应达到平衡状态.
解答 解:A.根据图象知,稀释相同的倍数,HA的pH变化快,所以HA的酸性比HB强,则相同浓度的钠盐溶液中,NaA溶液的pH小于同浓度的NaB溶液的pH,图象与实际相符,故A错误;
B.溶解度曲线上的点是饱和溶液,曲线以下的a点是不饱和溶液,图象曲线变化与实际相符,故B错误;
C.反应物大于生成物的总能量,则反应是放热反应,加入催化剂会降低活化能,改变反应的速率,但反应热不改变,图象曲线变化与实际相符,故C错误;
D.可逆反应2NO2?N204(g)中,分析判断,二氧化氮消耗速率和四氧化二氮的消耗速率之比为2:1时才能说明反应达到平衡状态,交点只是浓度相同不能证明达到终点,该说法不合理,故D正确;
故选D.
点评 本题考查较为综合,涉及弱电解质的电离、溶解度、化学平衡及其影响、反应速率等知识,题目难度中等,明确化学反应速率、化学平衡的影响因素为解答关键,注意明确弱电解质的电离平衡及其影响,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.下列有关化学用语表示正确的是( )
| A. | CO2的比例模型: | |
| B. | 氢氧根离子的电子式: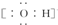 | |
| C. | 氯原子的结构示意图: | |
| D. | 中子数为146、质子数为92的铀(U)原子:${\;}_{92}^{146}$U |
14.短周期主族元素W、X、Y、Z的原子序数依次增大,W的一种单质是自然界中最硬的物质,工业上采用分馏液态空气的方法来生产X的单质,且X单质化学性质不活泼,Y、Z阴离子的核外电子数与氩原子电子数相同,且Y原子最外层电子数是其电子层数的2倍.下列有关该四种元素说法正确的是( )
| A. | 原子半径大小为W>X>Z>Y | |
| B. | X、Y、Z的氢化物的水溶液均呈酸性 | |
| C. | W与Y形成的三原子化合物既含极性共价键又含非极性共价键 | |
| D. | Z元素的最高价氧化物对应的水化物酸性最强 |
11.化学与环境、生活密切相关,下列与化学有关的说法正确的是( )
| A. | 春节燃放爆竹对环境无污染 | |
| B. | “酸雨”是由大气中的碳、氮、硫的氧化物溶于雨水造成 | |
| C. | 雾霾是一种分散系,分散剂是空气,带活性炭口罩防雾霾的原理是吸附原理 | |
| D. | 家庭用的“84”消毒液与洁厕灵可同时混合使用 |
8.化学与人类生活密切相关,下列与化学有关的说法正确的是( )
| A. | 化学药品着火,都要立即用水或泡沫灭火器灭火 | |
| B. | 明矾和漂白粉常用于自来水的净化,但两者的作用原理不相同 | |
| C. | 食品包装袋中常放入小袋的生石灰,目的是防止食品氧化变质 | |
| D. | 纤维素在人体内可水解为葡萄糖,故可作人类的营养物质 |
12.在BaSO4饱和溶液中,加入Na2SO4(s),达平衡时( )
| A. | c(Ba2+)、c(SO42-)均增大 | |
| B. | c(Ba2+)=c(SO42-)=[Ksp(BaSO4)]1/2 | |
| C. | c(Ba2+)≠c(SO42-),c(Ba2+)•c(SO42-)=Ksp(BaSO4) | |
| D. | c(Ba2+)≠c(SO42-),c(Ba2+)•c(SO42-)≠Ksp(BaSO4) |




 .
. .
. .
.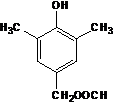 或
或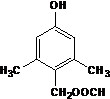 .
.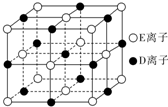 A、B、C、D、E、F为前四周期元素且原子序数依次增大,其中A含有3个能级,且每个能级所含的电子数相同;C的最外层有6个运动状态不同的电子;D是短周期元素中电负性最小的元素;E的最高价氧化物对应的水化物酸性最强;F除最外层原子轨道处于半充满状态,其余能层均充满电子.G元素与D元素同主族,且相差3个周期.
A、B、C、D、E、F为前四周期元素且原子序数依次增大,其中A含有3个能级,且每个能级所含的电子数相同;C的最外层有6个运动状态不同的电子;D是短周期元素中电负性最小的元素;E的最高价氧化物对应的水化物酸性最强;F除最外层原子轨道处于半充满状态,其余能层均充满电子.G元素与D元素同主族,且相差3个周期.