题目内容
4.把19.2g的Cu放入500mL2mol•L-1稀硝酸中,充分反应,Cu完全溶解.(1)Cu与稀硝酸反应的化学方程式为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O.
(2)反应后溶液中Cu2+物质的量浓度为0.6mol/L.(体积变化忽略不计)
(3)生成气体在标准状况下的体积为4.48L.
分析 (1)铜和稀硝酸反应生成硝酸铜和一氧化氮、水;
(2)n(Cu)=$\frac{19.2g}{64g/mol}$=0.3mol,根据c=$\frac{n}{V}$进行计算;
(3)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
3 2×22.4L
0.3mol xL
,由此解答.
解答 解:(1)铜和稀硝酸反应生成硝酸铜和一氧化氮、水,反应的化学方程式为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,故答案为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;
(2)n(Cu)=$\frac{19.2g}{64g/mol}$=0.3mol,根据c=$\frac{n}{V}$=$\frac{0.3mol}{0.5L}$=0.6mol/L,故答案为:0.6mol/L;
(3)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
3 2×22.4L
0.3mol xL
x=4.48
故答案为:4.48L.
点评 本题考查化学方程式的计算,学生只要列出比例关系就可以迅速解题,同时也考查了学生认真审题的能力,比较容易.

练习册系列答案
相关题目
10.下表是元素周期表的一部分,表中的每个字母代表一种短周期元素.
(1)d元素的最高价氧化物是Al2O3;
(2)a元素位于第三周期第IA族,它的元素符号是Na;
(3)e元素原子的最外层电子数为4;
(4)a、b、c三种元素的最高价氧化物对应水化物中碱性最弱的是Mg(OH)2(填化学式);
(5)h元素和i元素均可形成气态氢化物,其稳定性为H2h>H2i(填“大于”或“小于”);
(6)c元素和j元素形成化合物的化学式是MgCl2;
(7)j元素的单质跟氢气点燃的化学反应方程式:Cl2+H2$\frac{\underline{\;点燃\;}}{\;}$2HCl;
(8)b元素的单质与水反应的离子方程式:2K+2H2O=2OH-+2K++H2↑;
(9)f元素和g元素两者核电荷数之差是8.
| 周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | e | f | h | |||||
| 3 | a | c | d | g | i | j | r | |
| 4 | b |
(2)a元素位于第三周期第IA族,它的元素符号是Na;
(3)e元素原子的最外层电子数为4;
(4)a、b、c三种元素的最高价氧化物对应水化物中碱性最弱的是Mg(OH)2(填化学式);
(5)h元素和i元素均可形成气态氢化物,其稳定性为H2h>H2i(填“大于”或“小于”);
(6)c元素和j元素形成化合物的化学式是MgCl2;
(7)j元素的单质跟氢气点燃的化学反应方程式:Cl2+H2$\frac{\underline{\;点燃\;}}{\;}$2HCl;
(8)b元素的单质与水反应的离子方程式:2K+2H2O=2OH-+2K++H2↑;
(9)f元素和g元素两者核电荷数之差是8.
15.氢气是清洁的能源,也是重要的化工原料,有关氢气的制取研究是一个有趣的课题.根据提供两种制氢方法,完成下列各题:
(1)方法一:H2S热分解法,反应式为:2H2S(g)?2H2(g)+S2(g)△H 在恒容密闭容器中,控制不同温度进行H2S的分解实验.H2S的起始浓度均为c mol•L-1.不同温度下反应相同时间t后,测得如图所示H2S转化率曲线图.其中a为平衡转化率与温度关系曲线,b为未达到平衡时转化率与温度的关系曲线.
①△H>0(“>”、“<”或“=”),
②若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则tmi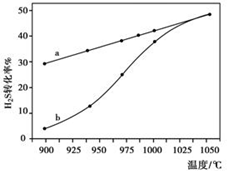 n内反应速率v(H2)=$\frac{0.4c}{t}$mol/(L•min)(用含c、t的代数式表示).
n内反应速率v(H2)=$\frac{0.4c}{t}$mol/(L•min)(用含c、t的代数式表示).
③请说明随温度的升高,曲线b向曲线a逼近的原因:温度的升高,反应速率加快,达到平衡所需时间缩短.
(2)方法二:以CaO为吸收体,将生物材质(以C计)与水蒸气反应制取H2.反应装置由气化炉和燃烧炉两个反应器组成,相关反应如下表所示:
①反应C(s)+2H2O(g)+CaO(s)?CaCO3(s)+2H2(g)K=K1•K2•K3.(用K1、K2、K3表示)
②对于可逆反应C(s)+2H2O(g)+CaO(s)?CaCO3(s)+2H2(g),△H=-87.9kJ•mol-1;采取以下措施可以提高H2产量的是AC.(填字母编号)
A.降低体系的温度 B.使各气体组分浓度均加倍
C.适当增加水蒸气的通入量 D.增加CaO的量,提高CO2的吸收率
(3)方法二与方法一相比其优点有实现了吸收剂CaO的循环,降低能耗(写一个即可).
(1)方法一:H2S热分解法,反应式为:2H2S(g)?2H2(g)+S2(g)△H 在恒容密闭容器中,控制不同温度进行H2S的分解实验.H2S的起始浓度均为c mol•L-1.不同温度下反应相同时间t后,测得如图所示H2S转化率曲线图.其中a为平衡转化率与温度关系曲线,b为未达到平衡时转化率与温度的关系曲线.
①△H>0(“>”、“<”或“=”),
②若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则tmi
 n内反应速率v(H2)=$\frac{0.4c}{t}$mol/(L•min)(用含c、t的代数式表示).
n内反应速率v(H2)=$\frac{0.4c}{t}$mol/(L•min)(用含c、t的代数式表示).③请说明随温度的升高,曲线b向曲线a逼近的原因:温度的升高,反应速率加快,达到平衡所需时间缩短.
(2)方法二:以CaO为吸收体,将生物材质(以C计)与水蒸气反应制取H2.反应装置由气化炉和燃烧炉两个反应器组成,相关反应如下表所示:
| 流程1:气化炉中产生H2 | 流程2:燃烧炉中CaO再生 |
| 通入水蒸气,主要化学反应: I:C(s)+H2O(g)?CO(g)+H2(g) K1 II:CO(g)+H2O(g)?CO2(g)+H2(g) K2 III:CaO(s)+CO2(g)?CaCO3(s) K3 | 通入纯氧,主要化学反应: IV:C(s)+O2(g)=CO2(g)△H=-393.8kJ•mol-1 V:CaCO3(s)=CaO(s)+CO2(g) |
②对于可逆反应C(s)+2H2O(g)+CaO(s)?CaCO3(s)+2H2(g),△H=-87.9kJ•mol-1;采取以下措施可以提高H2产量的是AC.(填字母编号)
A.降低体系的温度 B.使各气体组分浓度均加倍
C.适当增加水蒸气的通入量 D.增加CaO的量,提高CO2的吸收率
(3)方法二与方法一相比其优点有实现了吸收剂CaO的循环,降低能耗(写一个即可).
12.下列离子方程式表达正确的是( )
| A. | FeCl3溶液中加入铁粉:Fe3++Fe=2Fe2+ | |
| B. | 将NH3通入H2SO4溶液中:NH3+H+=NH4+ | |
| C. | FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl- | |
| D. | H2SO4溶液与Ba(OH)2溶液混合:H++OH-=H2O |
19.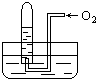 如图所示,试管中盛装的是红棕色气体,当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管;当向试管内鼓入氧气后,可以观察到试管中水面继续上升,经过多次重复后,试管被水充满,则原来试管中盛装的气体是( )
如图所示,试管中盛装的是红棕色气体,当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管;当向试管内鼓入氧气后,可以观察到试管中水面继续上升,经过多次重复后,试管被水充满,则原来试管中盛装的气体是( )
 如图所示,试管中盛装的是红棕色气体,当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管;当向试管内鼓入氧气后,可以观察到试管中水面继续上升,经过多次重复后,试管被水充满,则原来试管中盛装的气体是( )
如图所示,试管中盛装的是红棕色气体,当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管;当向试管内鼓入氧气后,可以观察到试管中水面继续上升,经过多次重复后,试管被水充满,则原来试管中盛装的气体是( )| A. | 肯定是NO2气体 | B. | 肯定是O2与NO2的混合气体 | ||
| C. | 肯定是NO与O2的混合气体 | D. | 可能是NO与NO2的混合气体 |
9.下列有关物质结构的说法中,正确的是( )
| A. | CO2和SiO2都是直线形分子 | |
| B. | H2O和NH3的VSEPR模型不同 | |
| C. | 由分子构成的物质中一定含有共价键 | |
| D. | 形成共价键的元素不一定是非金属元素 |
13.下列有关化学用语表示正确的是( )
| A. | CO2的比例模型: | |
| B. | 氢氧根离子的电子式: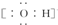 | |
| C. | 氯原子的结构示意图: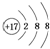 | |
| D. | 中子数为146、质子数为92的铀(U)原子:${\;}_{92}^{146}$U |
14.短周期主族元素W、X、Y、Z的原子序数依次增大,W的一种单质是自然界中最硬的物质,工业上采用分馏液态空气的方法来生产X的单质,且X单质化学性质不活泼,Y、Z阴离子的核外电子数与氩原子电子数相同,且Y原子最外层电子数是其电子层数的2倍.下列有关该四种元素说法正确的是( )
| A. | 原子半径大小为W>X>Z>Y | |
| B. | X、Y、Z的氢化物的水溶液均呈酸性 | |
| C. | W与Y形成的三原子化合物既含极性共价键又含非极性共价键 | |
| D. | Z元素的最高价氧化物对应的水化物酸性最强 |
 铁、铜均为日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铁、铜均为日常生活中常见的金属,有着广泛的用途.请回答下列问题: