题目内容
18.化学与生活密切相关,下列说法不正确的是( )| A. | 铝壶可存放食醋 | B. | 乙烯可催熟水果 | C. | 硅胶可作干燥剂 | D. | 氯气可做消毒剂 |
分析 A、铝与醋酸反应;
B、乙烯为植物生长调节剂;
C、硅胶吸附性;
D、氯气与水反应生成次氯酸,次氯酸具有氧化性.
解答 解:A、铝与醋酸反应,所以不能用铝壶可存放食醋,故A错误;
B、乙烯为植物生长调节剂,可用作水果催熟剂,故B正确;
C、硅胶吸附性,所以硅胶可作干燥剂,故C正确;
D、氯气与水反应生成次氯酸,次氯酸具有氧化性,所以可用氯气可做消毒剂,故D正确;
故选A.
点评 本题考查乙烯的用途、铝的化学性质、硅胶的性质、氯气的性质等,侧重于常识性内容的考查,难度不大,注意基础知识的积累.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目
9.下列有关物质结构的说法中,正确的是( )
| A. | CO2和SiO2都是直线形分子 | |
| B. | H2O和NH3的VSEPR模型不同 | |
| C. | 由分子构成的物质中一定含有共价键 | |
| D. | 形成共价键的元素不一定是非金属元素 |
13.下列有关化学用语表示正确的是( )
| A. | CO2的比例模型: | |
| B. | 氢氧根离子的电子式: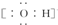 | |
| C. | 氯原子的结构示意图: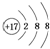 | |
| D. | 中子数为146、质子数为92的铀(U)原子:${\;}_{92}^{146}$U |
3.钛铁矿的主要成分为FeTiO3(可表示为FeO•TiO2).用浓盐酸溶解钛铁矿去渣得溶液(含有Fe2+、TiOCl42-等),调节溶液的pH并加热,过滤得TiO2和滤液.控制反应温度在95℃左右,向滤液中加入H2O2和NH4H2PO4得到FePO4.再将FePO4与Li2CO3和H2C2O4一起煅烧,可制取LiFePO4.有关数据如下表所示:
(1)FeTiO3中Ti的化合价为+4,盐酸与FeTiO3反应的离子方程式为FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O.检验溶液中Fe2+的方法是先滴加KSCN溶液,不显血红色,再加入过氧化氢,溶液显血红色.
(2)为提高FePO4的产率,根据上述制备方法和表中数据,应采取的正确措施是d(填正确答案的标号).
a.不加H2O2 b.调节溶液pH至5
c.降低反应温度 d.增大NH4H2PO4的用量
(3)磷的含氧酸H3PO2与足量的NaOH溶液反应,生成NaH2PO2,则H3PO2为一元酸;在LiFePO4中的化学键有离子键、共价键,在制备LiFePO4的过程中加入H2C2O4的作用是还原FePO4.
(4)LiFePO4可作锂电池的电极材料.充电时,Li+从LiFePO4晶格中迁移出来,部分LiFePO4转化为Li1-xFePO4,则阳极的电极反应式为LiFePO4-xe-═Li1-xFePO4+xLi+.
(5)电化学还原TiO2是获取金属钛的常用方法.采用熔融盐作电解质,用石墨做阳极,总反应为TiO2$\frac{\underline{\;电解\;}}{\;}$Ti+O2↑.
①电解过程中,阳极不断被消耗而需要定期更换,其原因是2O2--4e-═O2↑,C+O2=CO2(用反应式表示).
②电解由含80%FeTiO3的钛铁矿制取的TiO2得到12Kg金属钛,已知电流效率为76%,则至少需要该种钛铁矿62.5kg.(电流效率=$\frac{实际产量}{理论产量}$×100%)
| 化合物 | Fe(OH)2 | Fe(OH)3 | FePO4 | Fe3(PO4)2 |
| Ksp近似值 | 10-17 | 10-38 | 10-22 | 10-36 |
(2)为提高FePO4的产率,根据上述制备方法和表中数据,应采取的正确措施是d(填正确答案的标号).
a.不加H2O2 b.调节溶液pH至5
c.降低反应温度 d.增大NH4H2PO4的用量
(3)磷的含氧酸H3PO2与足量的NaOH溶液反应,生成NaH2PO2,则H3PO2为一元酸;在LiFePO4中的化学键有离子键、共价键,在制备LiFePO4的过程中加入H2C2O4的作用是还原FePO4.
(4)LiFePO4可作锂电池的电极材料.充电时,Li+从LiFePO4晶格中迁移出来,部分LiFePO4转化为Li1-xFePO4,则阳极的电极反应式为LiFePO4-xe-═Li1-xFePO4+xLi+.
(5)电化学还原TiO2是获取金属钛的常用方法.采用熔融盐作电解质,用石墨做阳极,总反应为TiO2$\frac{\underline{\;电解\;}}{\;}$Ti+O2↑.
①电解过程中,阳极不断被消耗而需要定期更换,其原因是2O2--4e-═O2↑,C+O2=CO2(用反应式表示).
②电解由含80%FeTiO3的钛铁矿制取的TiO2得到12Kg金属钛,已知电流效率为76%,则至少需要该种钛铁矿62.5kg.(电流效率=$\frac{实际产量}{理论产量}$×100%)
10.设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 64g Cu粉与足量硫粉加热完全反应生成Cu2S时失去的电子数为2NA | |
| B. | 足量的CO2与39gNa2O2发生反应转移的电子数为NA | |
| C. | 18g的D2O与NA个-CH3具有相同的电子数 | |
| D. | 6.0g醋酸晶体中含有H+的数目为0.1NA |
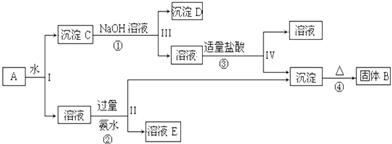
7.利用酸性含锰废水(主要锰废水(主要含Mn2+、Cl-、H+、Fe2+、Cu2+)可制备高性能磁性材料碳酸锰(Mn)纯净的氯化铜晶体(CuCl2•2H2O).工业流程如下:

已知某些物质完全沉淀的pH值如下表
回答下列问题:
(1)过程①中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,反应的离子方程式是MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O.
(2)过程②中,所得滤渣W的成分是Fe(OH)3和过量的MnO2.
(3)过程③中,调pH=6.4目的是使Cu2+ 完全沉淀为Cu(OH)2.
(4)过程④中,若生成的气体J可使澄清石灰水变浑浊,则生成MnCO3反应的离子方程式是Mn2++2HCO3-=MnCO3↓+CO2↑+H2O.
(5)将滤渣Q溶解在过量的盐酸中,经过加热浓缩,降温结晶,过滤、洗涤、低温烘干,即可获得纯净的氯化钠晶体(CuCl2•2H2O).
(6)过程④中,298K、c(Mn2+)为1.05mol•L-1时,实验测得MnCO3的产率与溶液pH、反应时间关系如图所示,据图中信息,你选择的最佳pH是7.0;理由是pH等于7.0时反应速率最快,且MnCO3产率最高.

(7)从滤液C可得到的副产品是NH4Cl(填化学式).

已知某些物质完全沉淀的pH值如下表
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
| 沉淀完全的pH | 9.7 | 3.7 | 6.4 | 10.4 |
(1)过程①中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,反应的离子方程式是MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O.
(2)过程②中,所得滤渣W的成分是Fe(OH)3和过量的MnO2.
(3)过程③中,调pH=6.4目的是使Cu2+ 完全沉淀为Cu(OH)2.
(4)过程④中,若生成的气体J可使澄清石灰水变浑浊,则生成MnCO3反应的离子方程式是Mn2++2HCO3-=MnCO3↓+CO2↑+H2O.
(5)将滤渣Q溶解在过量的盐酸中,经过加热浓缩,降温结晶,过滤、洗涤、低温烘干,即可获得纯净的氯化钠晶体(CuCl2•2H2O).
(6)过程④中,298K、c(Mn2+)为1.05mol•L-1时,实验测得MnCO3的产率与溶液pH、反应时间关系如图所示,据图中信息,你选择的最佳pH是7.0;理由是pH等于7.0时反应速率最快,且MnCO3产率最高.

(7)从滤液C可得到的副产品是NH4Cl(填化学式).
8.化学与人类生活密切相关,下列与化学有关的说法正确的是( )
| A. | 化学药品着火,都要立即用水或泡沫灭火器灭火 | |
| B. | 明矾和漂白粉常用于自来水的净化,但两者的作用原理不相同 | |
| C. | 食品包装袋中常放入小袋的生石灰,目的是防止食品氧化变质 | |
| D. | 纤维素在人体内可水解为葡萄糖,故可作人类的营养物质 |
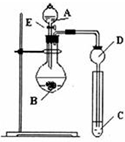 某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用如图装置完成了O元素的非金属性比S强的实验研究.
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用如图装置完成了O元素的非金属性比S强的实验研究.