题目内容
14.阿伏加德罗曾做过这样一个实验:“一抽真空的密闭容器重M g,在标准状况下,盛满以相同物质的量混合的NO和H2的混合气体后,称量为(M+Q)g.把混合气体排尽,再充满SO2气体,为使天平平衡,应在托盘天平的_边托盘上放置_ g砝码…”横线上分别应填的是( )| A. | 右 (M+2Q) | B. | 左 (M+2Q) | C. | 右 (M+4Q) | D. | 左 (M+4Q) |
分析 同一容器在同一条件下盛放不同的气体时,所含分子数必然相等,NO和H2按相同物质的量混合时,气体的平均相对分子质量为$\frac{30+2}{2}$=16,而SO2的相对分子质量为64,则相同体积SO2的与NO和H2的混合气体的质量为4:1,以此解答该题.
解答 解:同一容器在同一条件下盛放不同的气体时,所含分子数必然相等,NO和H2按相同物质的量混合时,气体的平均相对分子质量为$\frac{30+2}{2}$=16,而SO2的相对分子质量为64,
称量物品质量时,砝码应放在天平的右盘,
设密闭容器内气体的物质的量为n,则盛满以相同物质的量混合的NO和H2的混合气体后,气体的质量为16n=Q,n=$\frac{Q}{16}$,
当充满SO2气体时,气体的质量为:m=64n=64×$\frac{Q}{16}$=4Q,容器的总质量为M+4Q,
故选C.
点评 本题考查阿伏加德罗定律及推论,题目难度中等,做题时先计算混合气体的平均相对分子质量,再与SO2做比较进行计算.

练习册系列答案
相关题目
4.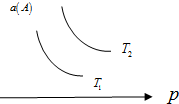 在一定条件下,某可逆反应aA(g)+bB(s)?cC(g)达到平衡后,A的转化率a(A)与温度(T)、压强(p)的关系如图所示,根据图象,下列判断正确的是( )
在一定条件下,某可逆反应aA(g)+bB(s)?cC(g)达到平衡后,A的转化率a(A)与温度(T)、压强(p)的关系如图所示,根据图象,下列判断正确的是( )
 在一定条件下,某可逆反应aA(g)+bB(s)?cC(g)达到平衡后,A的转化率a(A)与温度(T)、压强(p)的关系如图所示,根据图象,下列判断正确的是( )
在一定条件下,某可逆反应aA(g)+bB(s)?cC(g)达到平衡后,A的转化率a(A)与温度(T)、压强(p)的关系如图所示,根据图象,下列判断正确的是( )| A. | a+b<c | |
| B. | 若T2>T1,则该反应在高温下易自发进行 | |
| C. | △H>0 | |
| D. | 若T2<T1,则该反应一定不能自发进行 |
5.已知某密闭容器中发生反应:X(g)+Y(g)?2W(g)+Z(g)△H<0 (Y 物质易被液化).下列有关说法中一定正确的是( )
| A. | 若W为有颜色的物质,达平衡后,增大压强,体系颜色变浅 | |
| B. | 改变压强,该反应的平衡常数不变 | |
| C. | 平衡时,其他条件不变,升高温度,正反应速率增大程度比逆反应速率增大程度小 | |
| D. | 平衡时,其他条件不变,分离出 Z,正反应速率加快 |
2. Al、Ti、Fe、Cu是几种常见的重要金属.根据要求回答下列问题:
Al、Ti、Fe、Cu是几种常见的重要金属.根据要求回答下列问题:
(1)在火箭和导弹技术中,将铝粉与石墨、TiO2按一定比例混合均匀,涂在金属表面,在高温下煅烧,金属表面生成TiC和另外一种耐高温物质X,写出该反应的化学方程式4Al+3C+3TiO2$\frac{\underline{\;高温\;}}{\;}$3TiC+2Al2O3.
(2)Fe原子的价电子排布式为3d64s2,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.Fe和Mn的部分电离能数据如右表:
其中表示Fe电离能数据的是B (填A或B).
(3)向CuSO4溶液中加入氨水生成蓝色沉淀,继续加入氨水沉淀溶解,得到深蓝色透明溶液;最后向溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4•H2O(注:[Cu(NH3)4]2+为平面正四边形结构),该晶体存在的粒子中空间构型为正四面体的是SO42-,与其互为等电子体的分子为SiF4、CCl4(GeCl4)(写出两个即可);N原子的杂化方式为sp3.
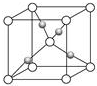
(4)Cu2O的晶胞结构如图所示,Cu+的配位数为2,该晶胞的边长为a pm,则Cu2O的密度为$\frac{288×1{0}^{30}}{{a}^{3}×{N}_{A}}$g/cm3(阿佛加德罗常数用NA表示,1m=1012pm)
 Al、Ti、Fe、Cu是几种常见的重要金属.根据要求回答下列问题:
Al、Ti、Fe、Cu是几种常见的重要金属.根据要求回答下列问题:(1)在火箭和导弹技术中,将铝粉与石墨、TiO2按一定比例混合均匀,涂在金属表面,在高温下煅烧,金属表面生成TiC和另外一种耐高温物质X,写出该反应的化学方程式4Al+3C+3TiO2$\frac{\underline{\;高温\;}}{\;}$3TiC+2Al2O3.
(2)Fe原子的价电子排布式为3d64s2,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.Fe和Mn的部分电离能数据如右表:
| 元素 | A | B | |
| 电离能(kJ/mol) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(3)向CuSO4溶液中加入氨水生成蓝色沉淀,继续加入氨水沉淀溶解,得到深蓝色透明溶液;最后向溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4•H2O(注:[Cu(NH3)4]2+为平面正四边形结构),该晶体存在的粒子中空间构型为正四面体的是SO42-,与其互为等电子体的分子为SiF4、CCl4(GeCl4)(写出两个即可);N原子的杂化方式为sp3.
(4)Cu2O的晶胞结构如图所示,Cu+的配位数为2,该晶胞的边长为a pm,则Cu2O的密度为$\frac{288×1{0}^{30}}{{a}^{3}×{N}_{A}}$g/cm3(阿佛加德罗常数用NA表示,1m=1012pm)
19.在0.1mol•L-1 NH3•H2O溶液中存在如下电离平衡:NH3•H2O?NH4++OH-.对于该平衡,下列叙述中正确的是( )
| A. | 加入水时,溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| B. | 降低温度,溶液中c(NH4+)增大 | |
| C. | 加入少量NaOH固体,平衡向左移动,电离平衡常数减小 | |
| D. | 加入少量0.1 mol•L-1 盐酸,溶液中c(OH-)增大 |
6.下列做法存在安全隐患的是( )
①将水沿烧杯内壁加入浓硫酸中,并不断搅拌
②实验室制取O2时,先撤导气管再撤酒精灯
③取用金属钠或钾做完实验后,将剩余药品放回原瓶
④夜间煤气发生泄漏时,应立即开灯检查煤气泄漏的原因,然后打开所有的门窗通风
⑤油锅起火可用水灭火.
①将水沿烧杯内壁加入浓硫酸中,并不断搅拌
②实验室制取O2时,先撤导气管再撤酒精灯
③取用金属钠或钾做完实验后,将剩余药品放回原瓶
④夜间煤气发生泄漏时,应立即开灯检查煤气泄漏的原因,然后打开所有的门窗通风
⑤油锅起火可用水灭火.
| A. | ①④⑤ | B. | ①②③④ | C. | ①②③④⑤ | D. | 全部 |
4.下列物质不可能通过化合反应得到的是( )
| A. | Al2S3 | B. | FeCl2 | C. | Fe(OH)3 | D. | H2SiO3 |
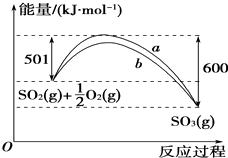 根据下列叙述写出相应的热化学方程式:
根据下列叙述写出相应的热化学方程式: