题目内容
18.下列有关说法正确的是( )| A. | KClO3和SO2溶于水后的溶液均可导电,故KClO3和SO2均为电解质 | |
| B. | CH3COOH溶液加水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$的值增大 | |
| C. | 反应NH3(g)+HCl(g)=NH4Cl(s)在室温下自发进行,则该反应的△H<0 | |
| D. | 向浓度均为0.1mol•L-1KI和NaCl混合溶液中,滴加几滴硝酸镍溶液,只得到AgI沉淀说明Ksp(Agl)<Ksp(AgCl) |
分析 A.电解质:在水溶液中或熔融状态下能导电的化合物;
B.在CH3COOH溶液中存在:CH3COOH?CH3COO-+H+常温下加水稀释,溶液中氢离子浓度减小,依据平衡常数表达式变换解答即可;
C.NH3(g)+HCl(g)=NH4Cl(s)中,△S<0,室温下可自发进行,则△H-T△S<0;
D.Ksp越小,越易生成沉淀.
解答 解:A.二氧化硫本身不能电离,其溶于水能导电的原因是二氧化硫与水反应生成的亚硫酸导电,二氧化硫是非电解质,故A错误;B.
CH3COOH?CH3COO-+H+常温下加水稀释,促进电离;
B.$K=\frac{c({H}^{+})×c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$,CH3COOH?CH3COO-+H+常温下加水稀释,溶液中氢离子浓度减小,$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}=\frac{c({H}^{+})}{K}$,温度不变,K不变,故此值减小,故B错误;
C.NH3(g)+HCl(g)=NH4Cl(s)中,△S<0,室温下可自发进行,则△H-T△S<0,可知该反应的△H<0,故C正确;
D.Ksp越小,越易生成沉淀,生成AgI,可说明Ksp(AgCl)>Ksp(AgI),故D正确,故选CD.
点评 本题考查较为综合,涉及物质的检验,性质的探究以及难溶电解质的溶解平衡等知识,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握实验的严密性和可行性的评价,难度不大.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
6.下列做法存在安全隐患的是( )
①将水沿烧杯内壁加入浓硫酸中,并不断搅拌
②实验室制取O2时,先撤导气管再撤酒精灯
③取用金属钠或钾做完实验后,将剩余药品放回原瓶
④夜间煤气发生泄漏时,应立即开灯检查煤气泄漏的原因,然后打开所有的门窗通风
⑤油锅起火可用水灭火.
①将水沿烧杯内壁加入浓硫酸中,并不断搅拌
②实验室制取O2时,先撤导气管再撤酒精灯
③取用金属钠或钾做完实验后,将剩余药品放回原瓶
④夜间煤气发生泄漏时,应立即开灯检查煤气泄漏的原因,然后打开所有的门窗通风
⑤油锅起火可用水灭火.
| A. | ①④⑤ | B. | ①②③④ | C. | ①②③④⑤ | D. | 全部 |
13.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 常温常压下,11.2 L氧气所含的分子数为NA | |
| B. | 1.8 g 的NH4+中含有的电子数为NA | |
| C. | 常温常压下,48 g O3含有的氧原子数为NA | |
| D. | 24 g金属镁变为镁离子时失去的电子数为NA |
8.最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程.反应过程的示意图如下:
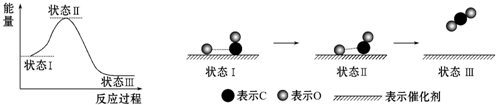
下列说法正确的是( )

下列说法正确的是( )
| A. | CO和O生成CO2是吸热反应 | |
| B. | 在该过程中,CO断键形成C和O | |
| C. | 状态Ⅰ→状态Ⅲ表示CO和O反应生成CO2的过程 | |
| D. | 状态Ⅰ→状态Ⅲ表示CO与O2反应生成CO2的过程 |
 根据下列叙述写出相应的热化学方程式:
根据下列叙述写出相应的热化学方程式: