题目内容
海水是巨大的资源宝库,利用海水提取食盐的过程如图所示.回答下列问题:
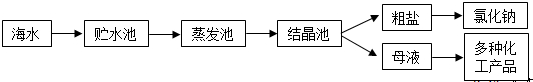
(1)①粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用试剂为:A:盐酸;B:BaCl2溶液;C:NaOH溶液;D:Na2CO3溶液.加入试剂的顺序是 .
②电解饱和食盐水时,与电源正极相连的电极上发生的反应为 ,
与电源负极相连的电极附近溶液pH的变化是 .
(2)工业上从海水中提取的NaCl,可用来制取纯碱,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱,①则气体B是 (填化学式),由NaCl制取纯碱反应的化学方程为 、 .
(3)采用空气吹出法从浓海水吹出Br2,并用纯碱吸收.碱吸收溴的主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3,吸收3mol Br2时,转移的电子数为 个.
(4)海水提镁的一段工艺流程如图:
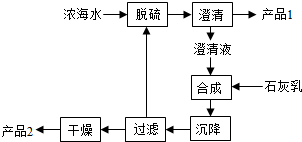
浓海水的主要成分如下:
该工艺过程中,脱硫阶段主要反应的离子方程式为 ,1L浓海水最多可得到产品2的物质的量为 mol.

(1)①粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用试剂为:A:盐酸;B:BaCl2溶液;C:NaOH溶液;D:Na2CO3溶液.加入试剂的顺序是
②电解饱和食盐水时,与电源正极相连的电极上发生的反应为
与电源负极相连的电极附近溶液pH的变化是
(2)工业上从海水中提取的NaCl,可用来制取纯碱,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱,①则气体B是
(3)采用空气吹出法从浓海水吹出Br2,并用纯碱吸收.碱吸收溴的主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3,吸收3mol Br2时,转移的电子数为
(4)海水提镁的一段工艺流程如图:

浓海水的主要成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g?L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
考点:海水资源及其综合利用
专题:
分析:(1)①根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子进行分析;
②根据电解池的工作原理,分析两个电极上放电的离子,并确定生成的物质,以此书写电极反应式以及判断溶液酸碱性;
(2)根据制取纯碱的原理:向饱和的氯化钠溶液中依次通入氨气、二氧化碳,析出碳酸氢钠晶体,加热碳酸氢钠晶体可制得纯碱;
(3)反应中Br2起氧化剂、还原剂作用,根据电子转移守恒可知,氧化剂与还原剂物质的量之比为5:1,据此计算;
(4)工艺流程合成步骤中加入石灰乳,沉降后,将过滤后的滤液进行脱硫,应是用钙离子沉淀硫酸根离子生成硫酸钙沉淀,产品1为硫酸钙,合成得到氢氧化镁沉淀,故过滤后干燥的产品2为氢氧化镁,计算1L溶液中Mg2+的质量,根据Mg2+~Mg(OH)2计算氢氧化镁的物质的量;
②根据电解池的工作原理,分析两个电极上放电的离子,并确定生成的物质,以此书写电极反应式以及判断溶液酸碱性;
(2)根据制取纯碱的原理:向饱和的氯化钠溶液中依次通入氨气、二氧化碳,析出碳酸氢钠晶体,加热碳酸氢钠晶体可制得纯碱;
(3)反应中Br2起氧化剂、还原剂作用,根据电子转移守恒可知,氧化剂与还原剂物质的量之比为5:1,据此计算;
(4)工艺流程合成步骤中加入石灰乳,沉降后,将过滤后的滤液进行脱硫,应是用钙离子沉淀硫酸根离子生成硫酸钙沉淀,产品1为硫酸钙,合成得到氢氧化镁沉淀,故过滤后干燥的产品2为氢氧化镁,计算1L溶液中Mg2+的质量,根据Mg2+~Mg(OH)2计算氢氧化镁的物质的量;
解答:
解:(1)①因用蒸发结晶的方法可以从海水中获得食盐,镁离子用氢氧根离子沉淀,加入过量的石灰乳可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,在进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以添加试剂的顺序为CBDA或BCDA,
故答案为:CBDA或BCDA;
②电解饱和食盐水时,与正极相连的阳极发生的反应是2Cl--2e-=Cl2↑,与负极相连的阴极发生的反应是:2H++2e=H2↑,H+不断消耗,使得溶液中C(OH-)增大,pH变大,
故答案为:2Cl--2e-=Cl2↑;变大;
(2)向饱和的氯化钠溶液中依次通入氨气、二氧化碳,则气体B是二氧化碳,析出碳酸氢钠晶体,加热碳酸氢钠晶体可制得纯碱,上述反应的化学方程式分别为NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓,2NaHCO3
Na2CO3+CO2↑+H2O,
故答案为:CO2;NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;2NaHCO3
Na2CO3+CO2↑+H2O;
(3)反应中Br2起氧化剂、还原剂作用,根据电子转移守恒可知,2×n氧化剂(Br2)=2×5×n还原剂(Br2),故n氧化剂(Br2):n还原剂(Br2)=5:1,故吸收1mol Br2时,转移的电子数为N=3mol×2×
×5NA=5NA,
故答案为:5NA;
(4)工艺流程合成步骤中加入石灰乳,沉降后,将过滤后的滤液进行脱硫,用Ca2+沉淀SO42-生成CaSO4沉淀,离子方程式为:Ca2++SO42-=CaSO4↓,采用过滤的方法得到产品1为CaSO4,滤液中加入石灰乳,发生反应为Mg2++2OH-=Mg(OH)2↓,合成中应得到Mg(OH)2沉淀,过滤、干燥的产品2为Mg(OH)2,
溶液中m(Mg2+)=1L×28.8g/L=28.8g,
Mg2+~Mg(OH)2
24g 58g
28.8g m[Mg(OH)2]
m[Mg(OH)2]=28.8g×
=69.6g,氢氧化镁的物质的量n[Mg(OH)2]=
=
=1.2mol,
故答案为:Ca2++SO42-=CaSO4↓;1.2;
故答案为:CBDA或BCDA;
②电解饱和食盐水时,与正极相连的阳极发生的反应是2Cl--2e-=Cl2↑,与负极相连的阴极发生的反应是:2H++2e=H2↑,H+不断消耗,使得溶液中C(OH-)增大,pH变大,
故答案为:2Cl--2e-=Cl2↑;变大;
(2)向饱和的氯化钠溶液中依次通入氨气、二氧化碳,则气体B是二氧化碳,析出碳酸氢钠晶体,加热碳酸氢钠晶体可制得纯碱,上述反应的化学方程式分别为NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓,2NaHCO3
| ||
故答案为:CO2;NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;2NaHCO3
| ||
(3)反应中Br2起氧化剂、还原剂作用,根据电子转移守恒可知,2×n氧化剂(Br2)=2×5×n还原剂(Br2),故n氧化剂(Br2):n还原剂(Br2)=5:1,故吸收1mol Br2时,转移的电子数为N=3mol×2×
| 1 |
| 1+5 |
故答案为:5NA;
(4)工艺流程合成步骤中加入石灰乳,沉降后,将过滤后的滤液进行脱硫,用Ca2+沉淀SO42-生成CaSO4沉淀,离子方程式为:Ca2++SO42-=CaSO4↓,采用过滤的方法得到产品1为CaSO4,滤液中加入石灰乳,发生反应为Mg2++2OH-=Mg(OH)2↓,合成中应得到Mg(OH)2沉淀,过滤、干燥的产品2为Mg(OH)2,
溶液中m(Mg2+)=1L×28.8g/L=28.8g,
Mg2+~Mg(OH)2
24g 58g
28.8g m[Mg(OH)2]
m[Mg(OH)2]=28.8g×
| 58g |
| 24g |
| m |
| M |
| 69.6g |
| 58g/mol |
故答案为:Ca2++SO42-=CaSO4↓;1.2;
点评:本题主要以海水化学资源的利用为背景,考查了粗盐的提纯、电解饱和食盐水、候氏制碱、海水中提取Mg的原理、化学反应计算等,掌握基础是关键,题目难度中等,培养了学生运用知识分析问题和解决问题的能力.

练习册系列答案
相关题目
将铁的化合物溶于盐酸,滴加KSCN溶液,不发生颜色变化,再加入适量氯水,溶液立即呈红色的是( )
| A、Fe2O3 |
| B、FeCl3 |
| C、Fe2(SO4)3 |
| D、FeO |
 可连接在E处,则Cl2从
可连接在E处,则Cl2从