题目内容
能源危机是当前全球面临的问题,研究化学反应热和开发新能源有重要的现实意义.
(1)金刚石和石墨均为碳的同素异形体,已知:C(金刚石,s)=C(石墨,s)△H=-1.9kJ/mol-1,C(金刚石,s)+O2(g)=CO2(g)△H=-395.4kJ/mol-1,则金刚石和石墨中 (填“金刚石”或“石墨”)更稳定,石墨的燃烧热△H= kJ/mol-1.
(2)已知:N2(g)+O2(g)=2NO(g)△H=+180kJ/mol-1,2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol-1,则CO(g)与NO(g)反应生成N2(g)和CO2(g)的热化学方程式为
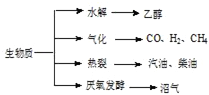
(3)生物质资源是一种污染小的可再生能源.生物质的主要转化途径及主要产物如下图.
①下列有关说法正确的是 .
a.生物质能,本质上能量来源于太阳能
b.由纤维素水解获得的乙醇作燃料是利用了生物质能
c.生物质裂解获得的汽油、柴油等属于纯净物
d.由植物秸杆等厌氧发酵获得的沼气,主要成分是甲烷
②由生物质能获得的CO和H2,可以合成甲醇和二甲醚(CH3OCH3)及许多烃类物质.当两者1:1催化反应,其原子利用率达100%,合成的物质可能是 .
a.汽油 b.甲醇(CH4O) c.甲醛(CH2O) d.乙酸(C2H4O2)
(1)金刚石和石墨均为碳的同素异形体,已知:C(金刚石,s)=C(石墨,s)△H=-1.9kJ/mol-1,C(金刚石,s)+O2(g)=CO2(g)△H=-395.4kJ/mol-1,则金刚石和石墨中
(2)已知:N2(g)+O2(g)=2NO(g)△H=+180kJ/mol-1,2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol-1,则CO(g)与NO(g)反应生成N2(g)和CO2(g)的热化学方程式为
(3)生物质资源是一种污染小的可再生能源.生物质的主要转化途径及主要产物如下图.

①下列有关说法正确的是
a.生物质能,本质上能量来源于太阳能
b.由纤维素水解获得的乙醇作燃料是利用了生物质能
c.生物质裂解获得的汽油、柴油等属于纯净物
d.由植物秸杆等厌氧发酵获得的沼气,主要成分是甲烷
②由生物质能获得的CO和H2,可以合成甲醇和二甲醚(CH3OCH3)及许多烃类物质.当两者1:1催化反应,其原子利用率达100%,合成的物质可能是
a.汽油 b.甲醇(CH4O) c.甲醛(CH2O) d.乙酸(C2H4O2)
考点:有关反应热的计算,化学在解决能源危机中的重要作用
专题:
分析:(1)根据C(金刚石,s)=C(石墨,s)△H=-1.9kJ/mol-1可知石墨和金刚石的能量高低,而能量越低物质越稳定;根据盖斯定律来求石墨的燃烧热;
(2)根据盖斯定律来解答;
(3)①a.生物质能来源于太阳能;
b.乙醇来源于纤维素;
c.混合物是指由多种物质组成的物质;
d.沼气的主要成分是甲烷;
②根据质量守恒定律和化合反应的定义和特点判断,主要是利用反应前后原子的种类不变,其数目必保持不变分析判断;
(2)根据盖斯定律来解答;
(3)①a.生物质能来源于太阳能;
b.乙醇来源于纤维素;
c.混合物是指由多种物质组成的物质;
d.沼气的主要成分是甲烷;
②根据质量守恒定律和化合反应的定义和特点判断,主要是利用反应前后原子的种类不变,其数目必保持不变分析判断;
解答:
解:(1)根据C(金刚石,s)=C(石墨,s)△H=-1.9kJ/mol-1可知石墨比金刚石的能量低,而能量越低物质越稳定,故石墨更稳定;
热化学方程式:C(金刚石,s)=C(石墨,s)△H=-1.9kJ/mol-1①
C(金刚石,s)+O2(g)=CO2(g)△H=-395.4kJ/mol-1②
根据盖斯定律和燃烧热的定义,将②-①可知:C(石墨,s)+O2(g)=CO2(g)△H=(-395.4kJ/mol-1)-(-1.9kJ/mol-1)=-393.5KJ/mol,
故答案为:石墨,-393.5;
(2)已知热化学方程式:N2(g)+O2(g)=2NO(g)△H=+180kJ/mol-1①
2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol-1②
根据盖斯定律,将②-①可得:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=(-566kJ/mol-1)-(+180kJ/mol-1)=-746KJ/mol,
故答案为:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746KJ/mol;
(3)①a.生物质本质上能来源于太阳能,故A正确;
b.乙醇来源于纤维素,属于生物质能,故B正确;
c.汽油、柴油等属于混合物,故C错误;
d.沼气的主要成分是甲烷,故D正确.
故选abd;
②“绿色化学”能实现零排放,即反应物中的原子利用率达到100%,也就是说反应类型一般是化合反应,且反应后产物中的各原子数目比不变,CO和H2在一定条件下按照不同的比例反应,可假定反应时的化学计量数之比为1:1,则只要各选项中的化学式能化为形式(CO)n(H2)n,都是正确的,汽油是混合物,甲醇(CH4O)可变为(CO)1(H2)2,甲醛(CH2O)可变为(CO)1(H2)1,乙酸(C2H4O2)可变为(CO)2(H2)2,故答案为:cd;
热化学方程式:C(金刚石,s)=C(石墨,s)△H=-1.9kJ/mol-1①
C(金刚石,s)+O2(g)=CO2(g)△H=-395.4kJ/mol-1②
根据盖斯定律和燃烧热的定义,将②-①可知:C(石墨,s)+O2(g)=CO2(g)△H=(-395.4kJ/mol-1)-(-1.9kJ/mol-1)=-393.5KJ/mol,
故答案为:石墨,-393.5;
(2)已知热化学方程式:N2(g)+O2(g)=2NO(g)△H=+180kJ/mol-1①
2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol-1②
根据盖斯定律,将②-①可得:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=(-566kJ/mol-1)-(+180kJ/mol-1)=-746KJ/mol,
故答案为:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746KJ/mol;
(3)①a.生物质本质上能来源于太阳能,故A正确;
b.乙醇来源于纤维素,属于生物质能,故B正确;
c.汽油、柴油等属于混合物,故C错误;
d.沼气的主要成分是甲烷,故D正确.
故选abd;
②“绿色化学”能实现零排放,即反应物中的原子利用率达到100%,也就是说反应类型一般是化合反应,且反应后产物中的各原子数目比不变,CO和H2在一定条件下按照不同的比例反应,可假定反应时的化学计量数之比为1:1,则只要各选项中的化学式能化为形式(CO)n(H2)n,都是正确的,汽油是混合物,甲醇(CH4O)可变为(CO)1(H2)2,甲醛(CH2O)可变为(CO)1(H2)1,乙酸(C2H4O2)可变为(CO)2(H2)2,故答案为:cd;
点评:本题考查了热化学方程式的书写方法和计算应用,盖斯定律的计算应用等,难度较大,注意知识的积累.

练习册系列答案
 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案
相关题目
已知Ksp(FeS)=6.3×10-18,Ksp(CuS)=6.3×10-36,K1(H2S)=1.3×10-20. 向0.10mol?L-1Fe2+和0.10mol?L-1Cu2+的混合溶液中通入H2S气体至饱和(c(H2S) 0.10mol?L-1).请推断沉淀生成情况是下列哪一种( )
| A、先生成CuS 沉淀,后生成FeS 沉淀 |
| B、先生成FeS 沉淀,后生成CuS 沉淀 |
| C、先生成CuS 沉淀,不生成FeS 沉淀 |
| D、先生成CuS 沉淀,反应一段时间FeS和CuS同时沉淀 |
存放下列试剂的方法中,有错误并且会引起危险的是( )
| A、白磷浸在盛有CS2的敞口试剂瓶中 |
| B、金属钠浸在盛有煤油的试剂瓶中 |
| C、浓硝酸存放在棕色试剂瓶中 |
| D、溴水放在带玻璃塞的试剂瓶中 |

 如图集气瓶中用滤纸折成的纸蝴蝶上喷洒了一种溶液,通入某种气体后,实验结果与预测的纸蝴蝶颜色变化不一致的是( )
如图集气瓶中用滤纸折成的纸蝴蝶上喷洒了一种溶液,通入某种气体后,实验结果与预测的纸蝴蝶颜色变化不一致的是( )