题目内容
某化学兴趣小组设计了如下实验方案探究NO3-在不同条件下的氧化性
【实验一】探究强酸性条件下NO3-的氧化性
实验步骤:在试管中加入适量的铝粉,加入2mLNaNO3溶液,再加入2mL盐酸
实验现象:①实验初始阶段,试管中未见明显现象;
②一段时间后,溶液中出现气泡,液面上方呈浅棕色且气体颜色逐渐变浅,用湿润KI-淀粉试纸检验该气体,试纸变蓝.
(1)实验初始阶段没有明显现象的是因为 .
(2)浅棕色气体是 ,根据现象②,推测溶液中产生了NO而不是NO2,理由是 .
探究强碱性条件下NO3-的氧化性
实验步骤:在试管中加入适量的铝粉,加入2mLNaNO3溶液,再加入2mLNaOH溶液
实验现象:实验初始阶段,试管中未见明显现象;一段时间后,溶液中出现气泡且有刺激性气味,用湿润KI-淀粉试纸检验所得气体,未变蓝;用湿润的石蕊试纸检验所得气体,试纸变蓝
(3)实验初始阶段发生的反应中,生成的盐是
(4)产生该气体的离子方程式是
【实验二】探究Fe(NO3)3溶液蚀刻银的原理
假设1:Fe3+具有氧化性,能氧化Ag.
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化Ag.
[设计实验方案,验证假设]
(2)甲同学从上述实验的生成物中检验出Fe2+,验证了假设1成立.请写出Fe3+氧化Ag的离子方程式:
3)乙同学设计实验验证假设2,请帮他完成下表中内容(提示:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生).
【实验一】探究强酸性条件下NO3-的氧化性
实验步骤:在试管中加入适量的铝粉,加入2mLNaNO3溶液,再加入2mL盐酸
实验现象:①实验初始阶段,试管中未见明显现象;
②一段时间后,溶液中出现气泡,液面上方呈浅棕色且气体颜色逐渐变浅,用湿润KI-淀粉试纸检验该气体,试纸变蓝.
(1)实验初始阶段没有明显现象的是因为
(2)浅棕色气体是
探究强碱性条件下NO3-的氧化性
实验步骤:在试管中加入适量的铝粉,加入2mLNaNO3溶液,再加入2mLNaOH溶液
实验现象:实验初始阶段,试管中未见明显现象;一段时间后,溶液中出现气泡且有刺激性气味,用湿润KI-淀粉试纸检验所得气体,未变蓝;用湿润的石蕊试纸检验所得气体,试纸变蓝
(3)实验初始阶段发生的反应中,生成的盐是
(4)产生该气体的离子方程式是
【实验二】探究Fe(NO3)3溶液蚀刻银的原理
假设1:Fe3+具有氧化性,能氧化Ag.
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化Ag.
[设计实验方案,验证假设]
(2)甲同学从上述实验的生成物中检验出Fe2+,验证了假设1成立.请写出Fe3+氧化Ag的离子方程式:
3)乙同学设计实验验证假设2,请帮他完成下表中内容(提示:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生).
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| ① ② … | 若银镜消失,假设2成立. 若银镜不消失,假设2不成立. |
考点:性质实验方案的设计
专题:实验设计题
分析:(1)铝粉在空气中发生缓慢氧化,在表面覆盖有一层致密的氧化膜;
(2)液面上方呈浅棕色且气体颜色逐渐变浅,说明生成的是无色气体,是一氧化氮;一氧化氮与空气中的氧气反应生成红棕色的二氧化氮;
(3)实验初始阶段,铝粉表面的氧化铝与氢氧化钠反应,生成偏铝酸钠和水;
(4)一段时间后,溶液中出现气泡且有刺激性气味,用湿润红色石蕊试纸检验所得气体,试纸变蓝,说明生成的气体是氨气,依此书写离子方程式;
(5)Fe3+氧化Ag,生成物是Fe2+和银离子,据此书写;
(6)对比实验,应选用相同的酸性环境,故需配置与Fe(NO3)3溶液的pH值相同的硝酸溶液,加入试管中,观察银镜是否溶解.
(2)液面上方呈浅棕色且气体颜色逐渐变浅,说明生成的是无色气体,是一氧化氮;一氧化氮与空气中的氧气反应生成红棕色的二氧化氮;
(3)实验初始阶段,铝粉表面的氧化铝与氢氧化钠反应,生成偏铝酸钠和水;
(4)一段时间后,溶液中出现气泡且有刺激性气味,用湿润红色石蕊试纸检验所得气体,试纸变蓝,说明生成的气体是氨气,依此书写离子方程式;
(5)Fe3+氧化Ag,生成物是Fe2+和银离子,据此书写;
(6)对比实验,应选用相同的酸性环境,故需配置与Fe(NO3)3溶液的pH值相同的硝酸溶液,加入试管中,观察银镜是否溶解.
解答:
解:(1)铝粉表面覆盖有一层氧化铝,氧化铝与硝酸反应,无明显现象,故答案为:铝粉表面覆盖有一层氧化铝;
(2)铝粉与稀硝酸反应生成无色的一氧化氮,一氧化氮与空气中的氧气反应生成红棕色的二氧化氮;液面上方呈浅棕色且气体颜色逐渐变浅,说明生成的是无色气体,是一氧化氮;
故答案为:二氧化氮;液面上方呈浅棕色且气体颜色逐渐变浅,说明生成的是无色气体;
(3)实验初始阶段,铝粉表面的氧化铝与氢氧化钠反应,生成偏铝酸钠和水,故生成的盐是偏铝酸钠,故答案为:偏铝酸钠;
(4)一段时间后,溶液中出现气泡且有刺激性气味,用湿润KI-淀粉试纸检验所得气体,未变蓝;用湿润红色石蕊试纸检验所得气体,试纸变蓝,说明生成的气体是氨气,反应的离子方程式为:3NO3-+8Al+5OH-+2H2O=3NH3↑+8AlO2-,
故答案为:3NO3-+8Al+5OH-+2H2O=3NH3↑+8AlO2-;
(5)Fe3+氧化Ag,生成物中检验出Fe2+,即发生反应为:Fe3++Ag=Fe2++Ag+,故答案为:Fe3++Ag=Fe2++Ag+;
(6)对比实验,应选用相同的酸性环境,故需配制与Fe(NO3)3溶液的pH值相同的硝酸溶液,加入试管中,观察银镜是否溶解,
故答案为:配制与Fe(NO3)3溶液的pH值相同的硝酸溶液,加入试管中,观察银镜是否溶解.
(2)铝粉与稀硝酸反应生成无色的一氧化氮,一氧化氮与空气中的氧气反应生成红棕色的二氧化氮;液面上方呈浅棕色且气体颜色逐渐变浅,说明生成的是无色气体,是一氧化氮;
故答案为:二氧化氮;液面上方呈浅棕色且气体颜色逐渐变浅,说明生成的是无色气体;
(3)实验初始阶段,铝粉表面的氧化铝与氢氧化钠反应,生成偏铝酸钠和水,故生成的盐是偏铝酸钠,故答案为:偏铝酸钠;
(4)一段时间后,溶液中出现气泡且有刺激性气味,用湿润KI-淀粉试纸检验所得气体,未变蓝;用湿润红色石蕊试纸检验所得气体,试纸变蓝,说明生成的气体是氨气,反应的离子方程式为:3NO3-+8Al+5OH-+2H2O=3NH3↑+8AlO2-,
故答案为:3NO3-+8Al+5OH-+2H2O=3NH3↑+8AlO2-;
(5)Fe3+氧化Ag,生成物中检验出Fe2+,即发生反应为:Fe3++Ag=Fe2++Ag+,故答案为:Fe3++Ag=Fe2++Ag+;
(6)对比实验,应选用相同的酸性环境,故需配制与Fe(NO3)3溶液的pH值相同的硝酸溶液,加入试管中,观察银镜是否溶解,
故答案为:配制与Fe(NO3)3溶液的pH值相同的硝酸溶液,加入试管中,观察银镜是否溶解.
点评:本题考查实验的设计与探究,难度大,有利于培养学生分析和解决问题的能力.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
下列电离或水解方程式中,正确的是( )
| A、HClO=ClO-+H+ |
| B、Cl-+H2O?HCl+OH- |
| C、CO32-+2H2O?H2CO3+2OH- |
| D、NH4++2H2O?NH3.H2O+H3O+ |
对于某些离子的检验及结论一定正确的是( )
| A、加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
| B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| C、加入硝酸银溶液有白色沉淀产生,一定有Cl- |
| D、加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
下列各组物质中,按单质、化合物、混合物顺序排列的是( )
| A、铁、四氧化三铁、冰水混合物 |
| B、金属钙、生石灰、碱石灰 |
| C、水银、空气、干冰 |
| D、二氧化硫、水蒸气、天然气 |
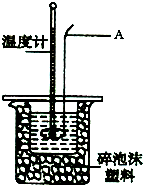 某实验小组用0.50mol?L-1NaOH溶液和0.50mol?L-1.1硫酸溶液进行中和热的测定.
某实验小组用0.50mol?L-1NaOH溶液和0.50mol?L-1.1硫酸溶液进行中和热的测定.