题目内容
HNO3与金属反应情况多种多样.为探究HNO3性质,某兴趣小组作如下探究:
(1)用浓硝酸和水按照不同体积比配成不同浓度的硝酸溶液,各取10mL硝酸溶液分别与铜片反应,实验记录如下:
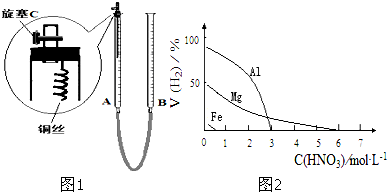
制备NO气体最适宜的是实验Ⅱ,理由是 .为防止有毒气体逸散造成空气污染,该小组同学改进实验装置,如图1所示(夹持仪器略去).安装好装置后,检查装置气密性操作 .
(2)盐酸对HNO3氧化性有影响.浓硝酸与浓盐酸按1:3体积比混合所得混合液称王水,具有强氧化性.金溶于王水产生遇空气变色的气体,金转化为易溶性强酸H[AuCl4].请写出其离子方程式: .
(3)与金属反应的过程中,HNO3能被还原成多种含氮产物,如:NO2、HNO2、NO、N2O、 、NH2OH、 .
(4)HNO3是一种强酸,与活泼金属反应时,HNO3的还原产物中可能存在H2,某兴趣小组设计实验,探究金属与稀HNO3反应制取H2的影响因素,其结果如图2所示.该实验中,金属与稀HNO3反应产生H2的影响因素: 、 .该兴趣小组设计以下实验,探究金属与HNO3反应产生H2的影响因素可供选择的试剂:Fe粉、Mg粉,HNO3(0.1mol?L-1、2.0mol?L-1)
(1)用浓硝酸和水按照不同体积比配成不同浓度的硝酸溶液,各取10mL硝酸溶液分别与铜片反应,实验记录如下:
| 序号 | 浓硝酸与水的体积比 | 实验现象 |
| Ⅰ | 1:1 | 反应速率快,溶液很快变成蓝色,铜丝表面有大量气泡冒出,气体呈红棕色 |
| Ⅱ | 1:3 | 反应速率较快,溶液变成蓝色,铜丝表面有大量气泡冒出,气体无色 |
| Ⅲ | 1:5 | 反应速率慢,微热后速率加快,溶液变成蓝色,铜丝表面有气泡冒出,气体无色 |
(2)盐酸对HNO3氧化性有影响.浓硝酸与浓盐酸按1:3体积比混合所得混合液称王水,具有强氧化性.金溶于王水产生遇空气变色的气体,金转化为易溶性强酸H[AuCl4].请写出其离子方程式:
(3)与金属反应的过程中,HNO3能被还原成多种含氮产物,如:NO2、HNO2、NO、N2O、
(4)HNO3是一种强酸,与活泼金属反应时,HNO3的还原产物中可能存在H2,某兴趣小组设计实验,探究金属与稀HNO3反应制取H2的影响因素,其结果如图2所示.该实验中,金属与稀HNO3反应产生H2的影响因素:
| 影响因素 | 实验步骤 | 实验结论 |
| 金属种类 | 两只烧瓶中各放入5g颗粒大小大致相同的Fe粉、Mg粉,分别加入 | 在该浓度的稀HNO3中,Mg能反应, |
| HNO3浓度 | 两只烧瓶中各放入5g颗粒大小大致相同的Mg粉,分别加入 | 硝酸浓度 |

考点:性质实验方案的设计,硝酸的化学性质
专题:实验设计题
分析:(1)制备NO气体最适宜的方案应该是反应速率较快,制得的气体是一氧化氮的方案;根据大气压强原理来检验装置的气密性;
(2)据N化合价下降的规律得出含氮元素的物质;
(3)根据题中信息,王水与金的反应中,反应物为金、硝酸根离子、氢离子、氯离子,生成物为AuCl4-、NO和水,据此写出反应的离子方程式;
(4)看图分析答题;金属与HNO3反应是放热反应,温度也会影响金属与HNO3反应产生H2,故要降温,选择实验方法.
(2)据N化合价下降的规律得出含氮元素的物质;
(3)根据题中信息,王水与金的反应中,反应物为金、硝酸根离子、氢离子、氯离子,生成物为AuCl4-、NO和水,据此写出反应的离子方程式;
(4)看图分析答题;金属与HNO3反应是放热反应,温度也会影响金属与HNO3反应产生H2,故要降温,选择实验方法.
解答:
解:(1)依据上表,实验Ⅱ的产物是NO,且反应速率较快(不用加热),所以制备NO气体最适宜的是实验Ⅱ,关闭旋塞C,从B管上端加入水,若观察到A、B间形成液面差,且保持不变,说明装置的气密性良好,故答案为:产物是NO,反应速率较快(不用加热);A、B间形成液面差,且保持不变;
(2)据N化合价下降的规律得出,空格的两个依次为0价和-3价,故物质为:N2、NH4+(或硝酸铵NH4NO3),
故答案为:N2、NH4+(或硝酸铵NH4NO3);
(3)由题中信息可知,金与王水反应的离子方程式为:4H++NO3-+Au?NO+Au3++2H2O、Au3++4Cl-=AuCl4-,反应的总离子方程式为:Au+4H++NO3-+4Cl-=NO↑+AuCl4-+2H2O,
故答案为:Au+4H++NO3-+4Cl-=NO↑+AuCl4-+2H2O;
(4)看图中受硝酸浓度和金属种类影响;HNO3的浓度有两种:0.1mol?L-1、2.0mol?L-1,看图可知:HNO3的浓度大于0.50mol?L-1时,铁不反应,故选HNO3的浓度2.0mol?L-1;两只烧瓶中各放入5g颗粒大小大致相同的Mg粉,即为金属相同,当然选不同浓度的硝酸来实验,看图得到实验结论为硝酸浓度越稀,产生氢气越多;金属与HNO3反应是放热反应,温度也会影响金属与HNO3反应产生H2,故要降温,选择冷水浴中进行实验.
故答案为:硝酸的浓度、金属的种类;2.0;Fe粉;0.1mol?L-1HNO3、2.0mol?L-1HNO3;越小.
(2)据N化合价下降的规律得出,空格的两个依次为0价和-3价,故物质为:N2、NH4+(或硝酸铵NH4NO3),
故答案为:N2、NH4+(或硝酸铵NH4NO3);
(3)由题中信息可知,金与王水反应的离子方程式为:4H++NO3-+Au?NO+Au3++2H2O、Au3++4Cl-=AuCl4-,反应的总离子方程式为:Au+4H++NO3-+4Cl-=NO↑+AuCl4-+2H2O,
故答案为:Au+4H++NO3-+4Cl-=NO↑+AuCl4-+2H2O;
(4)看图中受硝酸浓度和金属种类影响;HNO3的浓度有两种:0.1mol?L-1、2.0mol?L-1,看图可知:HNO3的浓度大于0.50mol?L-1时,铁不反应,故选HNO3的浓度2.0mol?L-1;两只烧瓶中各放入5g颗粒大小大致相同的Mg粉,即为金属相同,当然选不同浓度的硝酸来实验,看图得到实验结论为硝酸浓度越稀,产生氢气越多;金属与HNO3反应是放热反应,温度也会影响金属与HNO3反应产生H2,故要降温,选择冷水浴中进行实验.
故答案为:硝酸的浓度、金属的种类;2.0;Fe粉;0.1mol?L-1HNO3、2.0mol?L-1HNO3;越小.
点评:本题考查离子方程式的书写、看图分析能力,题目难度中等,注意掌握离子方程式的书写方法,试题培养了学生的看图分析、理解能力.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
相同温度、相同浓度下的六种电解质溶液,其pH由小到大的顺序如图所示,图中:①②③代表的物质可能分别为( )
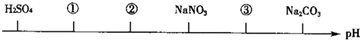
| A、NH4Cl;(NH4)2SO4;CH3COONa |
| B、(NH4)2SO4;NH4Cl;CH3COONa |
| C、(NH4)2SO4;NH4Cl;NaOH |
| D、CH3COOH;NH4Cl;(NH4)2SO4 |
 现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.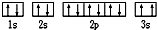 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了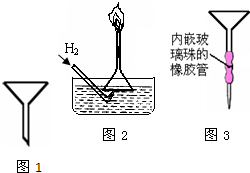 普通漏斗(见图1)是中学化学实验室常用仪器之一.我们对它的用途并不陌生.
普通漏斗(见图1)是中学化学实验室常用仪器之一.我们对它的用途并不陌生.
