题目内容
下列电离或水解方程式中,正确的是( )
| A、HClO=ClO-+H+ |
| B、Cl-+H2O?HCl+OH- |
| C、CO32-+2H2O?H2CO3+2OH- |
| D、NH4++2H2O?NH3.H2O+H3O+ |
考点:离子方程式的书写,电离方程式的书写
专题:
分析:A.次氯酸为弱电解质,不完全电离,应用可逆号;
B.氯离子为强酸酸根离子,不水解;
C.碳酸根为多元弱酸根离子,分步水解;
D.氨根离子水解生成一水合氨和氢离子.
B.氯离子为强酸酸根离子,不水解;
C.碳酸根为多元弱酸根离子,分步水解;
D.氨根离子水解生成一水合氨和氢离子.
解答:
解:A.次氯酸电离方程式为:HClO?ClO-+H+,故A错误;
B.氯离子不水解,故B错误;
C.碳酸根离子水解方程式:CO32-+H2O?HCO3-+OH-,故C错误;
D.氨根离子水解的离子方程式为:NH4++2H2O?NH3.H2O+H3O+,故D正确;
故选:D.
B.氯离子不水解,故B错误;
C.碳酸根离子水解方程式:CO32-+H2O?HCO3-+OH-,故C错误;
D.氨根离子水解的离子方程式为:NH4++2H2O?NH3.H2O+H3O+,故D正确;
故选:D.
点评:本题考查了电离方程式、水解反应的离子方程式的书写,明确电解质的强弱、盐类水解的规律是解题关键,题目难度不大,注意对基础知识的积累.

练习册系列答案
相关题目
下列说法中不正确的是( )
| A、电解MgCl2饱和溶液制取金属镁 |
| B、SO2具有还原性,可使酸性KMn04溶液退色 |
| C、双氧水被称为绿色氧化剂,是因为其还原产物为O2 |
| D、新制备的氯水中存在三种分子、四种离子 |
下列事实能用勒夏特列原理解释的是( )
| A、合成氨工业常采用合适的催化剂 |
| B、配制FeCl2溶液时在溶液中加入少量铁粉 |
| C、NO2与N2O4的平衡体系加压,气体颜色会变深 |
| D、向重铬酸钾溶液中滴加几滴氢氧化钠溶液后,溶液由橙色变为黄色 |
用NA表示阿伏伽德罗常数,下列说法正确的是( )
| A、100mL0.1mol/L的NaCl溶液中,所含微粒总数为0.02NA |
| B、在标准状况下,11.2LSO3所含分子数为0.5NA |
| C、1molNa与足量O2反应生成Na2O或Na2O2均失去NA电子 |
| D、两份质量为5.6g的铁分别与足量的盐酸、氯气反应,电子转移总数为0.3NA |
下列四种物质“水解”时,其反应物和产物之间化合价发生明显变化的是( )
| A、Na2O2的水解产物是NaOH和H2O2 |
| B、PCl3的水解产物是PH3和HClO |
| C、Mg3N2的水解产物是Mg(OH)2和NH3 |
| D、SiCl4的水解产物是H4SiO4与HCl |
下列实验设计及其对应的离子方程式均正确的是( )
| A、NO2与水反应:3NO2+H2O═2NO3-+NO+2H+ |
| B、Na2O2与H2O反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ |
| C、将氯气溶于水制备次氯酸:Cl2+H2O═2H++Cl-+ClO- |
| D、将铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ |
下列说法正确的是( )
| A、硫酸和食醋既是化合物又是酸 |
| B、含氧酸酸性越强与铁片反应放出氢气的速率越快 |
| C、含4%硅的硅钢具有很好的导磁性,主要用作变压器铁芯 |
| D、蛋白质、淀粉、纤维素、油脂等都能在人体内水解并提供能量 |
 现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.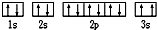 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了