题目内容
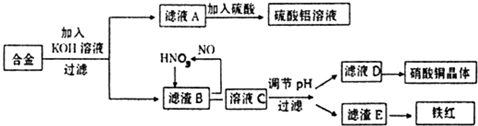
为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如图:请回答: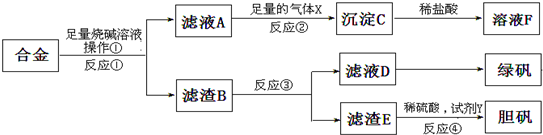
(1)操作①的名称是 .
(2)写出反应①的化学方程式 ,反应②的离子反应方程式 .
(3)设计实验方案,检测滤液D中含有的金属离子(试剂自选) .
(4)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是 .
(5)乙同学在甲同学方案的基础上提出用滤渣B来制备 FeCl3?6H2O晶体,在滤渣中滴加盐酸时,发现反应速率比同浓度盐酸与纯铁粉反应要快,其原因是 ,将所得氯化铁溶液用加热浓缩、降温结晶法制得FeCl3?6H2O晶体,而不用直接蒸发结晶的方法来制得晶体的理由是 .

(1)操作①的名称是
(2)写出反应①的化学方程式
(3)设计实验方案,检测滤液D中含有的金属离子(试剂自选)
(4)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是
(5)乙同学在甲同学方案的基础上提出用滤渣B来制备 FeCl3?6H2O晶体,在滤渣中滴加盐酸时,发现反应速率比同浓度盐酸与纯铁粉反应要快,其原因是
考点:金属的回收与环境、资源保护
专题:元素及其化合物
分析:(1)分离固体和液体的操作是过滤;
(2)金属铝可以和强碱发生反应生成偏铝酸盐和氢气;偏铝酸盐可以和二氧化碳气体反应生成氢氧化铝沉淀;
(3)根据亚铁离子的检验方法来回答;
(4)双氧水是一种绿色氧化剂,可以实现金属铜和硫酸之间的反应;
(5)滤渣B为铜和铁的混合物,加入稀盐酸后,铁与铜和稀盐酸构成原电池,加快反应速率,三价铁离子水解,生成盐酸,盐酸具有挥发性,据此解答即可.
(2)金属铝可以和强碱发生反应生成偏铝酸盐和氢气;偏铝酸盐可以和二氧化碳气体反应生成氢氧化铝沉淀;
(3)根据亚铁离子的检验方法来回答;
(4)双氧水是一种绿色氧化剂,可以实现金属铜和硫酸之间的反应;
(5)滤渣B为铜和铁的混合物,加入稀盐酸后,铁与铜和稀盐酸构成原电池,加快反应速率,三价铁离子水解,生成盐酸,盐酸具有挥发性,据此解答即可.
解答:
解:(1)依据题给信息得出操作①后得到的是滤液和滤渣,故此分离操作为过滤,故答案为:过滤;
(2)①金属铝可以和强碱氢氧化钠发生反应生成偏铝酸钠和氢气,即2Al+2NaOH+2H2O=2NaAlO2+3H2↑,偏铝酸钠中通入二氧化碳,则可以和二氧化碳气体反应生成氢氧化铝沉淀,即2H2O+AlO2-+CO2═Al(OH)3↓+HCO3-,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;2H2O+AlO2-+CO2═Al(OH)3↓+HCO3-;
(3)亚铁离子可以和强碱反应生成氢氧化亚铁沉淀,迅速被氧化为氢氧化铁,故亚铁离子的检验方法:取少量滤液D加入NaOH溶液,产生白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色,
故答案为:取少量滤液D加入NaOH溶液,产生白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色;
(4)双氧水是一种绿色氧化剂,在双氧水的作用下,金属铜可以和硫酸发生反应:Cu+H2O2+H2SO4+3H2O=CuSO4?5H2O,
故答案为:Cu+H2O2+H2SO4+3H2O=CuSO4?5H2O;
(5)铜与铁不与烧碱反应,故滤渣B为铜和铁,加入盐酸后,铁与铜和稀盐酸构成原电池,故加快了化学反应的速率,氯化铁溶液加热浓缩的过程中,发生反应:FeCl3+3H2O?Fe(OH)3+3HCl,由于HCl具有挥发性,故平衡右移,FeCl3转化为Fe(OH)3,加热蒸干,氢氧化铁分解生成氧化铁和水,故得不到FeCl3,
故答案为:滤渣中的铁与铜和稀盐酸构成原电池;氯化铁溶液加热浓缩的过程中,发生反应:FeCl3+3H2O?Fe(OH)3+3HCl,由于HCl具有挥发性,故平衡右移,FeCl3转化为Fe(OH)3,加热蒸干,氢氧化铁分解生成氧化铁和水.
(2)①金属铝可以和强碱氢氧化钠发生反应生成偏铝酸钠和氢气,即2Al+2NaOH+2H2O=2NaAlO2+3H2↑,偏铝酸钠中通入二氧化碳,则可以和二氧化碳气体反应生成氢氧化铝沉淀,即2H2O+AlO2-+CO2═Al(OH)3↓+HCO3-,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;2H2O+AlO2-+CO2═Al(OH)3↓+HCO3-;
(3)亚铁离子可以和强碱反应生成氢氧化亚铁沉淀,迅速被氧化为氢氧化铁,故亚铁离子的检验方法:取少量滤液D加入NaOH溶液,产生白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色,
故答案为:取少量滤液D加入NaOH溶液,产生白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色;
(4)双氧水是一种绿色氧化剂,在双氧水的作用下,金属铜可以和硫酸发生反应:Cu+H2O2+H2SO4+3H2O=CuSO4?5H2O,
故答案为:Cu+H2O2+H2SO4+3H2O=CuSO4?5H2O;
(5)铜与铁不与烧碱反应,故滤渣B为铜和铁,加入盐酸后,铁与铜和稀盐酸构成原电池,故加快了化学反应的速率,氯化铁溶液加热浓缩的过程中,发生反应:FeCl3+3H2O?Fe(OH)3+3HCl,由于HCl具有挥发性,故平衡右移,FeCl3转化为Fe(OH)3,加热蒸干,氢氧化铁分解生成氧化铁和水,故得不到FeCl3,
故答案为:滤渣中的铁与铜和稀盐酸构成原电池;氯化铁溶液加热浓缩的过程中,发生反应:FeCl3+3H2O?Fe(OH)3+3HCl,由于HCl具有挥发性,故平衡右移,FeCl3转化为Fe(OH)3,加热蒸干,氢氧化铁分解生成氧化铁和水.
点评:本题考查了过滤操作以及金属的回收,完成此题,可以依据已有的知识进行,该题综合性强,难度大.

练习册系列答案
相关题目
下列四种物质“水解”时,其反应物和产物之间化合价发生明显变化的是( )
| A、Na2O2的水解产物是NaOH和H2O2 |
| B、PCl3的水解产物是PH3和HClO |
| C、Mg3N2的水解产物是Mg(OH)2和NH3 |
| D、SiCl4的水解产物是H4SiO4与HCl |