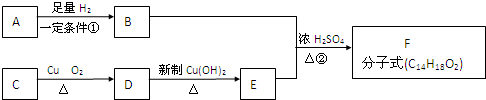
题目内容
 已知X、Y、Z、W四种短周期元素的原子序数依次增大,其中X与Y、Z、W所形成的常见化合物在常温下均呈气态,在周期表中Z与W左右相邻,Y的最高价氧化物的水化物与其氢化物反应生成盐,且Y的核电荷数与W的最外层电子数相同.请回答下列问题:
已知X、Y、Z、W四种短周期元素的原子序数依次增大,其中X与Y、Z、W所形成的常见化合物在常温下均呈气态,在周期表中Z与W左右相邻,Y的最高价氧化物的水化物与其氢化物反应生成盐,且Y的核电荷数与W的最外层电子数相同.请回答下列问题:(1)Z基态原子的核外电子排布式是
(2)X、Y可组成一化合物,其原子个数之比为5:1.其化学式中含有的化学键有
(3)YX3分子的空间构型是
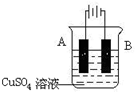
(4)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀.装置示意图如图,请回答:
①A电极对应的金属是
②镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因:
考点:位置结构性质的相互关系应用,金属的电化学腐蚀与防护
专题:元素周期律与元素周期表专题,电化学专题
分析:X、Y、Z、W四种短周期元素的原子序数依次增大,Y的最高价氧化物对应的水化物与其氢化物反应生成盐,则Y应为N元素;X的原子序数小于N元素,与N元素形成的常见化合物为气体,则X为H元素;Y的核电荷数为7,与W的最外层电子数相同,W处于ⅦA族,Z的原子序数小于W,周期表中W与Z左右相邻,则Z处于ⅥA族,H元素与Z、W所形成的常见化合物在常温下均呈气态,则Z为S元素、W为Cl元素,
根据以上分析 解答(1)-(3);
(4)电镀池中,作阳极的是镀层金属,做阴极的是待镀金属,金属阳离子在该极上发生得电子的还原反应,在原电池中,负极金属更易被腐蚀.
根据以上分析 解答(1)-(3);
(4)电镀池中,作阳极的是镀层金属,做阴极的是待镀金属,金属阳离子在该极上发生得电子的还原反应,在原电池中,负极金属更易被腐蚀.
解答:
解:X、Y、Z、W四种短周期元素的原子序数依次增大,Y的最高价氧化物对应的水化物与其氢化物反应生成盐,则Y应为N元素;X的原子序数小于N元素,与N元素形成的常见化合物为气体,则X为H元素;Y的核电荷数为7,与W的最外层电子数相同,W处于ⅦA族,Z的原子序数小于W,周期表中W与Z左右相邻,则Z处于ⅥA族,H元素与Z、W所形成的常见化合物在常温下均呈气态,则Z为S元素、W为Cl元素,
(1)Z为S元素,原子核外电子排布式为:1s22s22p63s23p4,
故答案为:1s22s22p63s23p4;
(2)H、N可组成一化合物,其原子个数之比为5:1,该化合物为NH4H,属于离子化合物,含有离子键,铵根离子中含有极性键、配位键,
故答案为:离子键、极性键、配位键;
(3)YX3为NH3,空间结构为三角锥形,中心N原子成3个σ键、含有1对孤对电子,杂化轨道数目为4,采取sp3杂化,氨气分子之间存在氢键,其沸点比HCl的沸点高,
故答案为:三角锥形;sp3杂化;高;
(4)①在铁件的表面镀铜的电镀池中,作阳极的是镀层金属铜,在铁件的表面镀铜的电镀池中,做阴极的是待镀金属铁,B连接电源负极,为电解池的阴极,该极上金属阳离子铜离子发生得电子的还原反应,则B电解反应式为:Cu2++2e-=Cu,
故答案为:铜;Cu2++2e-=Cu;
②镀铜铁破损后,金属铁为负极,镀锌铁破损后,金属铁是正极,在原电池中,负极金属更易被腐蚀,所以镀铜铁比镀锌铁更容易被腐蚀,
故答案为:镀铜铁破损后,金属铁为负极,镀锌铁破损后,金属铁是正极,负极金属易被腐蚀.
(1)Z为S元素,原子核外电子排布式为:1s22s22p63s23p4,
故答案为:1s22s22p63s23p4;
(2)H、N可组成一化合物,其原子个数之比为5:1,该化合物为NH4H,属于离子化合物,含有离子键,铵根离子中含有极性键、配位键,
故答案为:离子键、极性键、配位键;
(3)YX3为NH3,空间结构为三角锥形,中心N原子成3个σ键、含有1对孤对电子,杂化轨道数目为4,采取sp3杂化,氨气分子之间存在氢键,其沸点比HCl的沸点高,
故答案为:三角锥形;sp3杂化;高;
(4)①在铁件的表面镀铜的电镀池中,作阳极的是镀层金属铜,在铁件的表面镀铜的电镀池中,做阴极的是待镀金属铁,B连接电源负极,为电解池的阴极,该极上金属阳离子铜离子发生得电子的还原反应,则B电解反应式为:Cu2++2e-=Cu,
故答案为:铜;Cu2++2e-=Cu;
②镀铜铁破损后,金属铁为负极,镀锌铁破损后,金属铁是正极,在原电池中,负极金属更易被腐蚀,所以镀铜铁比镀锌铁更容易被腐蚀,
故答案为:镀铜铁破损后,金属铁为负极,镀锌铁破损后,金属铁是正极,负极金属易被腐蚀.
点评:本题考查了位置结构与性质的关系、金属的腐蚀与防护,题目难度中等,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用所学知识的能力,注意掌握原电池、电解池的工作原理,明确原子结构与元素周期表、元素周期律的关系.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
测定空气中污染物含量的一种方法是:将一定体积的空气通入吸收剂,并测定其导电能力的变化.用上述方法测定空气中氯气的含量时,导电能力变化最大的是( )
| A、H2S溶液 |
| B、KI溶液 |
| C、NaOH溶液 |
| D、Na2S溶液 |