题目内容
12.将一定量的镁和铜组成的混合物加入到稀硝酸中,金属恰好完全溶解(假设反应中还原产物只有NO).向反应后的溶液中加入3mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加 5.1g.下列叙述不正确的是( )| A. | 当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4 mol | |
| B. | 参加反应的金属的总质量 3.6 g<m<9.6 g | |
| C. | 当生成的沉淀量达到最大时,消耗NaOH溶液的体积V=200 mL | |
| D. | 当金属全部溶解时收集到NO气体的体积在标况下为 2.24 L |
分析 将一定量的镁和铜组成的混合物加入到稀HNO3中,金属完全溶解(假设反应中还原产物只有NO),发生反应:3Mg+8HNO3 (稀)=3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3 (稀)=3Cu(NO3)2+2NO↑+4H2O;
向反应后的溶液中加入过量的3mol/L NaOH溶液至沉淀完全,发生反应:Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加5.1g,则氢氧化镁和氢氧化铜含有氢氧根的质量为5.1g,氢氧根的物质的量为$\frac{5.1g}{17g/mol}$=0.3mol,根据电子转移守恒,则镁和铜的总的物质的量为0.15mol,以此来解答.
解答 解:将一定量的镁和铜组成的混合物加入到稀HNO3中,金属完全溶解(假设反应中还原产物只有NO),发生反应3Mg+8HNO3 (稀)=3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3 (稀)=3Cu(NO3)2+2NO↑+4H2O;
向反应后的溶液中加入过量的3mol/L NaOH溶液至沉淀完全,发生反应:Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加5.1g,则氢氧化镁和氢氧化铜含有氢氧根的质量为5.1g,氢氧根的物质的量为$\frac{5.1g}{17g/mol}$=0.3mol,根据电子转移守恒,则镁和铜的总的物质的量为0.15mol,
A.根据方程式可知参加反应的n反应(HNO3)=$\frac{8}{3}$n(金属)=0.15mol×$\frac{8}{3}$=0.4mol,故A正确;
B.镁和铜的总的物质的量为0.15mol,假定全为镁,质量为0.15mol×24g/mol=3.6g,若全为铜,质量为0.15mol×64g/mol=9.6g,所以参加反应的金属的总质量(m)为3.6g<m<9.6g,故B正确;
C.若硝酸无剩余,则参加反应氢氧化钠的物质的量等于0.3mol,需要氢氧化钠溶液体积=$\frac{0.3mol}{3mol/L}$=0.1L=100mL,硝酸若有剩余,消耗的氢氧化钠溶液体积大于100mL,故C错误;
D.镁和铜的总的物质的量为0.15mol,根据电子转移守恒可知生成的NO物质的量为$\frac{0.15mol×2}{3}$=0.1mol,若为标准状况下,生成NO的体积为0.1mol×22.4L/mol=2.24L,故D正确;
故选C.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的发反应、电子及原子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法应用,题目难度不大.

| 实验 | 操作 | |
| A | 用苯萃取碘水中碘后,静置后取出有机层 | 先从分液漏斗下端管口放出下层液体,关闭活塞,换一个接收容器,再继续从分液漏斗下端管口放出上层液体 |
| B | 配制500mL2mol/L的氯化铵溶液 | 用托盘天平称取53.5g氯化铵晶体放入500mL容量瓶,加少量水,振荡后再加水至刻度线 |
| C | 测定氯水的pH | 用玻璃棒蘸取少量溶液滴于pH试纸中央,片刻后与标准比色卡对照 |
| D | 用标准盐酸滴定未知浓度的NaOH溶液(含酚酞) | 左手控制酸式滴定管活塞使液体滴下,右手不断振荡锥形瓶,眼睛要始终观察锥形瓶中溶液颜色变化 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 单位物质的量的气体所占的体积就是气体摩尔体积 | |
| B. | 通常状况(室温、101kP)下,气体摩尔体积约为22.4L/mol | |
| C. | 标准状况(0℃、101kP)下,气体摩尔体积约为22.4 L | |
| D. | 标准状况(0℃、101kP)下,1 mol H2O的体积是22.4 L |
| 实验装置 | 电解质溶液 | 实验现象 | |
 | 5mol/L NaCl溶液 | a极附近 | b极附近 |
| 开始时,产生白色浑浊并逐渐增加,当沉入U形管底部时部分沉淀变为橙黄色;随后a极附近沉淀自下而上也变为橙黄色 | 产生无色气泡 | ||
①氯化亚铜(CuCl)为白色粉末,微溶于水;
②氢氧化亚铜(CuOH)为黄色不溶于水的固体,易脱水分解为红色的Cu2O;
③Cu+水溶液中不稳定,酸性条件下易歧化为Cu2+和Cu;
④氢氧化铜可以溶于浓NaOH得到蓝色溶液.
(1)经检验,b极产生的气体是H2,b极附近溶液的pH增大(填“增大”、“减小”、或“不变”);铜丝a应与电源的正(填“正”或“负”)极相连.
(2)同学们分析a极附近生成的白色浑浊是CuCl,则该极的电极反应式是Cu-e-+Cl-=CuCl↓.
(3)①橙黄色沉淀中含有Cu2O,则CuCl转化为Cu2O的原因是CuCl+OH-=CuOH+Cl-、2CuOH=Cu2O+H2O(用方程式表示);
②结合离子在溶液中的运动规律,解释“a极附近沉淀自下而上”变为橙黄色原因是通电时,在阴极产生的OH-向阳极定向移动.
(4)同学们通过实验进一步证实沉淀中含有:将橙黄色沉淀滤出洗涤后,滴加0.2mol/L H2SO4至过量,应观察到的现象是淀溶解,溶液变蓝,且有少量红色固体产生.
(5)同学们根据上述实验提出猜想:电解时,Cu做阳极先被氧化为Cu+.为此,他们用Cu电极电解5mol/L NaOH溶液,实验时观察到阳极产生大量无色气泡,附近溶液变蓝,未见预期的黄色沉淀.根据现象能否得出“该猜想不成立”的结论,并说明理由:不能,阳极产生的大量O2可能将CuOH氧化.
| A. | O2、SO2 | B. | NH3、N2 | C. | NO、O2 | D. | NH3、HCl |
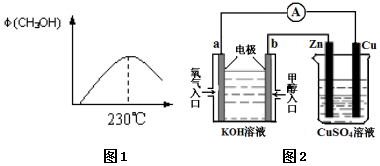 能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一.
能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一.