题目内容
12.肼(N2H4)可以用作制药原料,也可用作火箭和喷气发动机的燃料.
(1)在纳米钴的催化作用下,肼可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝.若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图1所示,则N2H4发生分解反应的化学方程式为:3N2H4$\frac{\underline{催化剂}}{△}$N2+4NH3;为抑制肼的分解,可采取的合理措施有降低反应温度(任写一种).
(2)已知:
反应Ⅰ:N2H4(g)?N2(g)+2H2(g)△H1
反应Ⅱ:N2(g)+3H2(g)?2NH3(g)△H2
①△H1>(填“>”“<”或“=”)△H2.
②反应:3N2H4(g) 2NH3(g)+2N2(g)+3H2(g)的△H=3△H1 +2△H2(用含△H1、△H2的代数式表示).
③在30℃、Ni/Pt催化下,向体积为1L的恒容密闭容器中加入0.1mol N2H4,发生反应I.反应在4min时达到平衡,测得容器中$\frac{n({N}_{2})+n({H}_{2})}{n({N}_{2}{H}_{4})}$与时间的关系如图2所示.则0~4min内氢气的平均速率v(H2)=0.025mol/L•min,反应的平衡常数K=0.01.
(3)N2H4可用于制备燃料电池,其结构如图3所示.
①通入空气的电极为正极(填“正极”或“负极”),该电池的负极反应式为N2H4-4e-+4OH-=N2+4H2O
②用此电池进行电镀铜,开始时电镀槽中两极质量相等,当两极质量相差1.28g时,消耗N2H4的质量为0.16g.
分析 (1)使湿润的红色石蕊试纸变蓝的气体为氨气,由图1得知:温度越高,肼的百分含量越低,即分解的越快;
(2)①反应Ⅰ:N2H4(g)?N2(g)+2H2(g)△H1,反应是分解反应属于吸热反应;
②依据盖斯定律和热化学方程式计算得到3N2H4(g)?2NH3(g)+2N2(g)+3H2(g)的△H;
③反应在4min时达到平衡,比值为3.0,结合化学平衡三行计算列式计算,设分解的肼物质的量浓度为x,
N2H4(g)?N2(g)+2H2(g)
起始量 0.1 0 0
变化量 x x 2x
平衡量 0.1-x x 2x
$\frac{n({N}_{2})+n({H}_{2})}{n({N}_{2}{H}_{4})}$等于其浓度之比=$\frac{x+2x}{0.1-x}$=3.0
x=0.05mol/L,反应速率V=$\frac{△c}{△t}$,平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
(3)①燃料电池是燃料做负极失电子发生氧化反应,氧气在正极得到电子发生还原反应;
②用此电池进行电镀铜,开始时电镀槽中两极质量相等,依据电子守恒和电极反应计算;
解答 解:(1)使湿润的红色石蕊试纸变蓝的气体为氨气,即肼分解生成氨气,依据元素守恒得知另外一种产物为氮气,故化学反应方程式为:3N2H4$\frac{\underline{催化剂}}{△}$N2+4NH3,由图1可知,温度越高,肼的体积分数含量越低,故要抑制肼的分解,应降低反应温度,故答案为:3N2H4$\frac{\underline{催化剂}}{△}$N2+4NH3;降低反应温度;
(2)①反应Ⅰ:N2H4(g)?N2(g)+2H2(g)△H1,反应是分解反应属于吸热反应,△H1>0,
故答案为:>;
②反应Ⅰ:N2H4(g)?N2(g)+2H2(g)△H1
反应Ⅱ:N2(g)+3H2(g)?2NH3(g)△H2
依据盖斯定律和热化学方程式计算,Ⅰ×3+Ⅱ×2得到3N2H4(g)?2NH3(g)+2N2(g)+3H2(g)△H=3△H1 +2△H2,
故答案为:3△H1 +2△H2;
③反应在4min时达到平衡,比值为3.0,结合化学平衡三行计算列式计算,设分解的肼物质的量浓度为x,
N2H4(g)?N2(g)+2H2(g)
起始量 0.1 0 0
变化量 x x 2x
平衡量 0.1-x x 2x
$\frac{n({N}_{2})+n({H}_{2})}{n({N}_{2}{H}_{4})}$等于其浓度之比=$\frac{x+2x}{0.1-x}$=3.0
x=0.05mol/L,
反应速率V=$\frac{△c}{△t}$=$\frac{2×0.05mol/L}{4min}$=0.025mol/L•min,
平衡常数K=$\frac{(2×0.05)^{2}×0.05}{0.1-0.05}$=0.01,
故答案为:0.025mol/L•min,0.01;
(3)①N2H4可用于制备燃料电池,通入空气的电极为原电池的正极,通N2H4的电极为原电池负极,碱性介质中的电极反应为:N2H4-4e-+4OH-=N2+4H2O,
故答案为:正极,N2H4-4e-+4OH-=N2+4H2O;
②用此电池进行电镀铜,开始时电镀槽中两极质量相等,当两极质量相差1.28g时,物质的量=$\frac{1.28g}{64g/mol}$=0.02mol,Cu-2e-=Cu2+,Cu2++2e-=Cu,电子转移2mol电子,两个电极质量相差128g,则当两极质量相差1.28g时,即物质的量为0.02mol,电子转移0.02mol,N2H4-4e-+4OH-=N2+4H2O,消耗肼的质量=$\frac{0.02}{4}$mol×32g/mol=0.16g,
故答案为:0.16:
点评 本题考查热化学方程书写、化学平衡计算、原电池原理应用等知识点,是对学生综合能力的考查,关键是原电池电解反应、电子守恒的计算,题目难度中等.

 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案| A. | Na+、K+、HCO3-、NO3- | B. | NH4+、Al3+、SO42-、NO3- | ||
| C. | K+、Fe2+、NH4+、NO3- | D. | NH4+、Na+、NO3-、OH- |
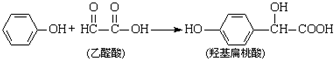
下列有关说法正确的是( )
| A. | 该反应是取代反应 | |
| B. | 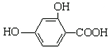 和羟基扁桃酸互为同系物 和羟基扁桃酸互为同系物 | |
| C. | 1个烃基扁桃酸分子中最多有17个原子共平面 | |
| D. | 1mol羟基扁桃酸分子最多能分别和1mol NaHCO3、2mol Na0H、3mol Na、4mol H2发生反应 |
| A. | 热化学方程式中,如果没有注明温度和压强,则表示反应热是在标准状况下测得的数据 | |
| B. | 升高温度或加入催化剂,不能改变化学反应的反应热 | |
| C. | 据能量守恒定律,反应物的总能量一定等于生成物的总能量 | |
| D. | 物质发生化学变化不一定伴随着能量变化 |
N2(g)+2O2(g)═N2O4(g)△H=+8.7kJ/mol
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ/mol
下列表示肼和N2O4反应的热化学方程式,正确的是( )
| A. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1076.7 kJ/mol | |
| B. | N2H4(g)+$\frac{1}{2}$N2O4(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-542.7 kJ/mol | |
| C. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-542.7 kJ/mol | |
| D. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(l)△H=-1059.3 kJ/mol |
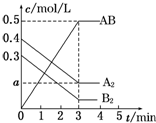 在一个容积为2L的密闭容器中,加入0.8mol A2气体和0.6mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)═2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示.下列说法正确的是( )
在一个容积为2L的密闭容器中,加入0.8mol A2气体和0.6mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)═2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示.下列说法正确的是( )| A. | 图中a点的值为0.05 | B. | 该反应的平衡常数K=0.03 | ||
| C. | 平衡时A2的转化率为62.5% | D. | 温度升高,平衡常数K值增大 |
| A. | 胶体粒子能够发生布朗运动而且能产生丁达尔现象 | |
| B. | 胶体粒子带电荷并且在一定条件下能稳定存在 | |
| C. | 胶体粒子不能穿过半透膜,能通过滤纸空隙 | |
| D. | 胶体的分散质粒子直径在1nm~100nm之间 |
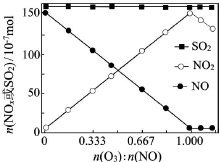 烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为: