题目内容
19.反应A(g)+3B(g)═2C(g)+D(g),在四种不同的情况下,反应速率分别如下,其中该反应进行最快的是( )| A. | v(A)=0.15 mol•(L•s)-1 | B. | v(B)=0.6 mol•(L•s)-1 | ||
| C. | v(C)=0.6 mol•(L•s)-1 | D. | v(D)=0.2 mol•(L•s)-1 |
分析 不同物质表示的速率之比等于其化学计量数之比,故不同物质表示的速率与其化学计量数的比值越大,表示的反应速率越快,注意单位保持一致.
解答 解:不同物质表示的速率之比等于其化学计量数之比,故不同物质表示的速率与其化学计量数的比值越大,表示的反应速率越快.
A.$\frac{v(A)}{1}$=0.15 mol•(L•s)-1;
B.$\frac{v(B)}{3}$=0.2 mol•(L•s)-1;
C.$\frac{v(C)}{2}$=0.3 mol•(L•s)-1;
D.$\frac{v(D)}{1}$=0.2 mol•(L•s)-1,
故反应速率v(C)>v(B)=v(D)>v(A),
故选:C.
点评 比较反应速率常用的两种方法:(1)归一法:将同一反应中的不同物质的反应速率转化成同一物质的反应速率,再较小比较.(2)比值法:用各物质的量表示的反应速率除以对应各物质的化学计量数,数值大的反应速率快.

练习册系列答案
相关题目
9.下列说法正确的是( )
| A. | 第三周期主族元素从左到右,氧化物对应的水化物酸性依次增强 | |
| B. | H2O比H2S的稳定性强,是因为其分子之间存在氢键 | |
| C. | 金刚石呈正四面体网状结构、C60呈笼状结构,这两种晶体中微粒间的作用力不完全相同 | |
| D. | NH4Cl属于离子化合物,该物质中只存在离子键 |
7.某有机物的结构简式如图所示,关于它的叙述不正确的是( )
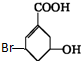

| A. | 该有机物的分子式为C7H9O3Br | |
| B. | 该有机物可使溴水褪色 | |
| C. | 该有机物可发生加成反应、消去反应、取代反应等 | |
| D. | 1mol该有机物与NaOH溶液反应时只能消耗1molNaOH |
14.下列过程中:①电离、②电解、③电镀、④电焊、⑤电化学腐蚀,需要通电才能进行的是( )
| A. | ①② | B. | ②③④ | C. | ③④⑤ | D. | 全部 |
4.在恒容的密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g)△H<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
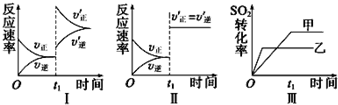

| A. | 图Ⅰ研究的是t1时刻,升高了反应的温度 | |
| B. | 图Ⅱ研究的是t1时刻加入催化剂后对反应速率的影响 | |
| C. | 图Ⅲ若是研究不同压强对平衡的影响,且乙反应的压强较高 | |
| D. | 图Ⅲ若是研究不同温度对平衡的影响,且乙的反应温度较高 |
11.赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热发生以下反应:Cu2S+2Cu2O═6Cu+SO2↑,关于该反应的说法中,正确的是( )
| A. | Cu2S在反应中既是氧化剂,又是还原剂 | |
| B. | 该反应的氧化剂只有Cu2O | |
| C. | Cu既是氧化产物又是还原产物 | |
| D. | 每生成19.2gCu,反应中转移1.8mol电子 |
8.已知25°C时,某浓度NaCN(氰化钠)溶液pH=11,则下列有关说法中不正确的是( )
| A. | HCN的电离方程式:HCN?H++CN- | |
| B. | NaCN是一种弱电解质 | |
| C. | NaCN溶液中一定存在:c(Na+)>c(CN-) | |
| D. | 0.1mol•L-1NaCN溶液中:c(CN-)+c(HCN)=0.1mol•L-1 |
9.对于下列常见化学原理的认识错误 的是( )
| A. | 明矾可用作净水剂 | |
| B. | 酒精可用于杀菌、消毒 | |
| C. | 碳酸钙是陶瓷文物的主要成分 | |
| D. | 小苏打是一种膨松剂,可用于制作馒头和面包 |