题目内容
8.已知25°C时,某浓度NaCN(氰化钠)溶液pH=11,则下列有关说法中不正确的是( )| A. | HCN的电离方程式:HCN?H++CN- | |
| B. | NaCN是一种弱电解质 | |
| C. | NaCN溶液中一定存在:c(Na+)>c(CN-) | |
| D. | 0.1mol•L-1NaCN溶液中:c(CN-)+c(HCN)=0.1mol•L-1 |
分析 某浓度NaCN(氰化钠)溶液pH=11,溶液呈碱性,说明NaCN是强碱弱酸盐,所以HCN是弱电解质,由此分析解答.
解答 解:A、HCN是弱电解,电离用可逆符号,所以HCN的电离方程式:HCN?H++CN-,故A正确;
B、NaCN是盐,是强电解质,故B错误;
C、NaCN是强碱弱酸盐,酸根离子水解,所以NaCN溶液中一定存在:c(Na+)>c(CN-),故C正确;
D、根据物料守恒,0.1mol•L-1NaCN溶液中:c(CN-)+c(HCN)=c(Na+)=0.1mol•L-1,故D正确;
故选B.
点评 本题考查离子浓度大小比较,题目难度中等,注意把握离子浓度大小的方法,解题时注意守恒思想的应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.以下各反应中,生成物的总能量高于反应物的总能量的是( )
| A. | 甲烷燃烧 | B. | Ba(OH)2•8H2O与NH4Cl反应 | ||
| C. | 铝片与盐酸反应 | D. | 氧化钙与水反应 |
19.反应A(g)+3B(g)═2C(g)+D(g),在四种不同的情况下,反应速率分别如下,其中该反应进行最快的是( )
| A. | v(A)=0.15 mol•(L•s)-1 | B. | v(B)=0.6 mol•(L•s)-1 | ||
| C. | v(C)=0.6 mol•(L•s)-1 | D. | v(D)=0.2 mol•(L•s)-1 |
3.下列根据实验现象所得的结论中,一定正确的是( )
| A. | 无色溶液使红色石蕊试纸变蓝,结论:溶液显碱性 | |
| B. | 无色溶液焰色反应呈黄色,结论:试液是钠盐溶液 | |
| C. | 无色溶液加入Na2CO3溶液产生白色沉淀,结论:溶液中含Ca(OH)2 | |
| D. | 向溶液中加入BaCl2溶液,生成白色沉淀,再加稀HCl,沉淀不溶解,可断定含有SO42ˉ |
20.一种微粒的质子数和电子数分别与另一种微粒的质子数和电子数相同,则下列说法中错误的是( )
| A. | 可能是不同的分子与原子 | B. | 可能是不同的离子 | ||
| C. | 可能是一种离子和一种分子 | D. | 可能是某位素的同位素原子 |
17.亚硝酸钠NaNO2与NH4Cl反应实验室常用制取N2,另生成两种常见化学物质.下列有关说法正确的是( )
| A. | NaNO2是还原剂 | |
| B. | NH4Cl中N元素被还原 | |
| C. | 生成1 mol N2时转移6 mol 电子 | |
| D. | 氧化剂和还原剂的物质的量之比是1:1 |

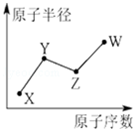 U、V、W、X、Y、Z是六种常见的短周期主族元素,其中W、X、Y、Z原子半径随原子序数的变化如图所示:
U、V、W、X、Y、Z是六种常见的短周期主族元素,其中W、X、Y、Z原子半径随原子序数的变化如图所示: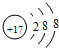 ;
;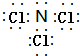 ;
;