题目内容
8.有八种物质:①甲烷 ②苯 ③聚丙烯 ④聚1,3-丁二烯 ⑤2-丁炔 ⑥环己烷 ⑦邻二甲苯 ⑧裂解气,既能使KMnO4酸性溶液褪色,又能与溴水反应褪色的是( )| A. | ③④⑤⑥⑦⑧ | B. | ④⑤⑧ | C. | ④⑤⑦⑧ | D. | ③④⑤⑧ |
分析 既能使酸性KMnO4溶液褪色又能与溴水反应使之褪色,应为烯烃或炔烃类物质,以此来解答.
解答 解:①甲烷均不能使高锰酸钾、溴水反应而褪色,故不选;
②苯均不能使高锰酸钾、溴水反应而褪色,故不选;
③聚丙烯中不含碳碳双键,均不能使高锰酸钾、溴水反应而褪色,故不选;
④聚1,3-丁二烯中含碳碳双键,既能使酸性KMnO4溶液褪色又能与溴水反应使之褪色,故选;
⑤2-丁炔中含碳碳三键,既能使酸性KMnO4溶液褪色又能与溴水反应使之褪色,故选;
⑥环己烷均不能使高锰酸钾、溴水反应而褪色,故不选,故不选;
⑦邻二甲苯能被高锰酸钾氧化,而不能与溴水反应褪色,故不选;
⑧裂解气中含不饱和烃,则既能使酸性KMnO4溶液褪色又能与溴水反应使之褪色,故选,
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握不饱和烃的性质为解答的关键,注意苯的同系物不与溴水反应,注重基础知识的考查,题目难度不大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
18.下列说法中,不正确的是:①金属钠、氢气都能在氯气中燃烧,分别生成白色的烟和雾②铜丝在氯气中燃烧,生成蓝绿色的氯化铜③液氯就是氯气的水溶液,它能使干燥的有色布条褪色④久置的氯水,因氯气几乎完全挥发掉,剩下的就是水( )
| A. | ②③ | B. | ①② | C. | ①④ | D. | ①②③④ |
19.已知K2Cr2O7溶液中存在如下平衡:Cr2O72-(橙色)+H2O?2H++2CrO42-(黄色).
①向2mL 0.1mol•L-1 K2Cr2O7溶液中滴入3滴6mol•L-1 NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色;
②向酸化K2Cr2O7溶液中滴入适量Na2SO3溶液,溶液由橙色变为绿色:
Cr2O72-+8H++3SO32-═2Cr3+(绿色)+3SO42-+4H2O.下列分析正确的是( )
①向2mL 0.1mol•L-1 K2Cr2O7溶液中滴入3滴6mol•L-1 NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色;
②向酸化K2Cr2O7溶液中滴入适量Na2SO3溶液,溶液由橙色变为绿色:
Cr2O72-+8H++3SO32-═2Cr3+(绿色)+3SO42-+4H2O.下列分析正确的是( )
| A. | CrO42-和S2-在酸性溶液中可大量共存 | |
| B. | 实验②说明氧化性:Cr2O72->SO42- | |
| C. | 稀释K2Cr2O7溶液时,溶液中各离子浓度均减小 | |
| D. | 实验①和②均能证明K2Cr2O7溶液中存在上述平衡 |
3.下列关于氧化还原反应的说法中不正确的是( )
| A. | 有单质参加的化合反应一定是氧化还原反应 | |
| B. | 有单质生成的分解反应一定是氧化还原反应 | |
| C. | 置换反应一定是氧化还原反应 | |
| D. | 有单质参加或生成的反应一定是氧化还原反应 |
13.某有机化合物的结构如图,关于该化合物的下列说法正确的是( )
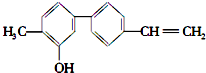

| A. | 由于含有氧元素不是有机物 | B. | 该物质的分子式是 C15H14O | ||
| C. | 分子中含有羟基属于醇 | D. | 分子中有三种官能团 |
20.下列事实中,不能用勒夏特列原理加以解释的是( )
| A. | 醋酸溶液加水稀释醋酸的电离程度增大 | |
| B. | 工业合成氨时常用通过过量的氮气的方法提高氢气的转化率 | |
| C. | 新制的氯水在光照的条件下颜色变浅 | |
| D. | 氯化铁溶液中加Fe粉振荡后颜色变浅 |
18.有机物A和B分子中都有2个碳原子,室温时A为气体B为液体,A在催化剂作用下与水反应生成一种含氧化合物C.C经催化氧化生成B,则三种物质是( )
| A. | A是CH2=CH2 B是CH3CHO C是CH3CH2OH | |
| B. | A是CH3CHO B是CH2=CH2C是CH3CH2OH | |
| C. | A是CH≡CH B是CH3CH2OH C是CH3CHO | |
| D. | A是CH3CH2OH B是CH3-CH3C是CH≡CH |
