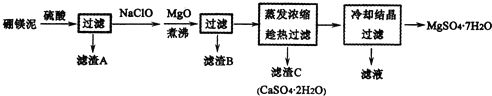
题目内容
14.将1mol Na和1mol Mg分别投入到等量的盐酸中,分别得到溶液a和b,则溶液a和b的质量关系为ma=mb.分析 钠溶于盐酸后,溶液增加的质量=钠的质量-氢气的质量,镁溶于盐酸后,溶液增加的质量=镁的质量-氢气的质量.
解答 解:1mol钠和1mol镁反应时盐酸均过量,钠和镁均完全反应,故生成的氢气的物质的量取决于钠和镁.1mol钠和盐酸反应生成0.5mol氢气,1mol镁和足量盐酸反应生成1mol氢气,氯化钠溶液中增加的质量=23g/mol×1mol-0.5mol×2g/mol=22g,
氯化镁溶液中增加的质量=24g/mol×1mol-1mol×2g/mol=22g,所以溶液a和b的质量大小关系为ma=mb,
若盐酸不足,溶液增重的量也只取决于钠和镁,
故答案为:=.
点评 本题考查化学方程式计算,比较基础,注意利用差量法进行解答.

练习册系列答案
相关题目
9.滴定实验是化学学科中重要的定量实验.请回答下列问题:
Ⅰ.酸碱中和滴定--已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下步骤实验:
①称量1.00g样品溶于水,配成250mL溶液; ②准确量取25.00mL所配溶液于锥形瓶中;③滴加几滴酚酞溶液;④用0.10mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如下:
(1)用酸式滴定管(填“酸式”或“碱式”)盛装0.10mol/L的盐酸标准液.
(2)试样中NaOH的质量分数为80%.
(3)若出现下列情况,测定结果偏高的是ce.
a.滴定前用蒸馏水冲洗锥形瓶
b.在振荡锥形瓶时不慎将瓶内溶液溅出
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外
d.酸式滴定管滴至终点对,俯视读数
e.酸式滴定管用蒸馏水洗后,未用标准液润洗
Ⅱ.氧化还原滴定-取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol•L-1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+10CO2↑+2MnSO4+8H2O.
(4)滴定时,KMnO4溶液应装在酸式滴定管中,滴定终点时滴定现象是滴入最后一滴KMnO4溶液,溶液由无色变为浅紫红色,且半分钟不褪色
Ⅲ.沉淀滴定--滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶.
(5)参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是D (填选项字母).
A.NaCl B.NaBr C.NaCN D.Na2CrO4.
Ⅰ.酸碱中和滴定--已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下步骤实验:
①称量1.00g样品溶于水,配成250mL溶液; ②准确量取25.00mL所配溶液于锥形瓶中;③滴加几滴酚酞溶液;④用0.10mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如下:
| 滴定序号 | 待测液体积 | 所消耗盐酸标准的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 25.00 | 0.50 | 20.60 |
| 2 | 25.00 | 6.00 | 26.00 |
| 3 | 25.00 | 1.10 | 21.00 |
(2)试样中NaOH的质量分数为80%.
(3)若出现下列情况,测定结果偏高的是ce.
a.滴定前用蒸馏水冲洗锥形瓶
b.在振荡锥形瓶时不慎将瓶内溶液溅出
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外
d.酸式滴定管滴至终点对,俯视读数
e.酸式滴定管用蒸馏水洗后,未用标准液润洗
Ⅱ.氧化还原滴定-取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol•L-1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+10CO2↑+2MnSO4+8H2O.
(4)滴定时,KMnO4溶液应装在酸式滴定管中,滴定终点时滴定现象是滴入最后一滴KMnO4溶液,溶液由无色变为浅紫红色,且半分钟不褪色
Ⅲ.沉淀滴定--滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶.
(5)参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是D (填选项字母).
| 难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
6.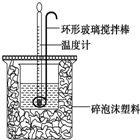 利用如图所示装置测定中和热的实验步骤如下:
利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50mL 0.50mol•L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50mL 0.55mol•L-1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度,回答下列问题:
(1)为什么所用NaOH溶液要稍过量?确保盐酸被完全中和.
(2)倒入NaOH溶液的正确操作是C (填序号).
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是D (填序号).
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌 C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)实验中改用60mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所求中和热相等(填“相等”、“不相等”).
(5)假设50mL 0.50mol•L-1盐酸和50mL 0.55mol•L-1氢氧化钠溶液的密度都是1g•cm-3,又知中和反应后生成溶液的比热容C=4.18J•g-1•℃-1,放出热量计算公式:Q=(m1+m2)•C•(t2-t1).为了计算中和热,某学生实验记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热51.8 kJ (结果保留一位小数).
 利用如图所示装置测定中和热的实验步骤如下:
利用如图所示装置测定中和热的实验步骤如下:①用量筒量取50mL 0.50mol•L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50mL 0.55mol•L-1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度,回答下列问题:
(1)为什么所用NaOH溶液要稍过量?确保盐酸被完全中和.
(2)倒入NaOH溶液的正确操作是C (填序号).
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是D (填序号).
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌 C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)实验中改用60mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所求中和热相等(填“相等”、“不相等”).
(5)假设50mL 0.50mol•L-1盐酸和50mL 0.55mol•L-1氢氧化钠溶液的密度都是1g•cm-3,又知中和反应后生成溶液的比热容C=4.18J•g-1•℃-1,放出热量计算公式:Q=(m1+m2)•C•(t2-t1).为了计算中和热,某学生实验记录数据如下:
| 实验 序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
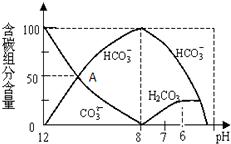 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.