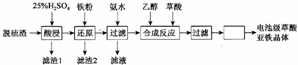
题目内容
4.在一定温度下,将2mol A和2mol B两种气体相混合于容积为2L的某密闭容器中,发生如下反应3A(g)+B(g)?xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8mol D,并测得C的浓度为0.4mol/L,请填写下列空白:(1)x值等于2.
(2)A的转化率为60%.
(3)生成D的反应速率为0.2mol/(L.min).
分析 2min末反应达到平衡状态,生成了0.8mol D,v(D)=$\frac{\frac{0.8mol}{2L}}{2min}$=0.2mol/(L.min),v(C)=$\frac{0.4mol/L}{2min}$=0.2mol/(L.min),结合反应速率之比等于化学计量数之比计算x,生成了0.8mol D,由反应可知,转化的A为0.8mol×$\frac{3}{2}$=1.2mol,以此计算.
解答 解:(1)2min末反应达到平衡状态,生成了0.8mol D,v(D)=$\frac{\frac{0.8mol}{2L}}{2min}$=0.2mol/(L.min),v(C)=$\frac{0.4mol/L}{2min}$=0.2mol/(L.min),
由反应速率之比等于化学计量数之比可知,$\frac{x}{2}=\frac{0.2mol/(L.min)}{0.2mol/(L.min)}$,解得x=2,
故答案为:2;
(2)生成了0.8mol D,由反应可知,转化的A为0.8mol×$\frac{3}{2}$=1.2mol,A的转化率为$\frac{1.2mol}{2mol}$×100%=60%,故答案为:60%;
(3)由(1)可知,v(D)=0.2mol/(L.min),故答案为:0.2mol/(L.min).
点评 本题考查化学平衡的计算,为高频考点,把握反应速率的计算、转化率的计算及反应速率与化学计量数的关系等为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.硝酸铝是一种常用皮革鞣剂.工业上用铝灰(主要合Al、A12O3、Fe2O3等)制取硝酸铝晶体[Al(NO3)3﹒nH2O]的流程如下:
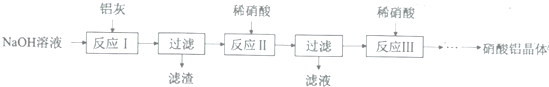
完成下列填空:
(1)用NaOH固体配制30%的NaOH溶液,所需的玻璃仪器除烧杯外,还有b.
a容量瓶 b量筒 c.烧瓶
(2)反应Ⅱ中为避免铝的损失,需要解决的问题是如何控制反应终点(或硝酸的用量).
(3)从反应Ⅲ所得溶液中得到硝酸铝晶体的步骤依次是:减压蒸发、冷却结晶、过滤、洗涤、低温烘干.
(4)有人建议将反应Ⅱ、Ⅲ合并以简化操作,说明工业上不采用这种方法的原因产物中杂质NaNO3的含量较高.
(5)某同学在实验室用铝灰制各硝酸铝晶体,其流程如下:
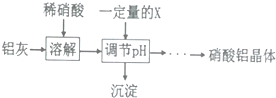
调节pH的目的是将Fe3+转化为Fe(OH)3沉淀除去.为使得到的硝酸铝晶体较纯净,所用的X物质可以是BC(填编号).
A.氨水 B.铝 c.氢氧化铝 D.偏铝酸钠
(6)该实验室制法与工业上制法相比,其缺点是产生大量污染性气体NO等.
(7)称取7.392g硝酸铝晶体样品,加热灼烧使其分解完全,最终得到1.020gAl2O3,计算硝酸铝晶体样品中结晶水的数目为8.7.

完成下列填空:
(1)用NaOH固体配制30%的NaOH溶液,所需的玻璃仪器除烧杯外,还有b.
a容量瓶 b量筒 c.烧瓶
(2)反应Ⅱ中为避免铝的损失,需要解决的问题是如何控制反应终点(或硝酸的用量).
(3)从反应Ⅲ所得溶液中得到硝酸铝晶体的步骤依次是:减压蒸发、冷却结晶、过滤、洗涤、低温烘干.
(4)有人建议将反应Ⅱ、Ⅲ合并以简化操作,说明工业上不采用这种方法的原因产物中杂质NaNO3的含量较高.
(5)某同学在实验室用铝灰制各硝酸铝晶体,其流程如下:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 |
| 开始沉淀pH | 1.9 | 4.2 |
| 沉淀完全pH | 3.2 | 5.4 |

调节pH的目的是将Fe3+转化为Fe(OH)3沉淀除去.为使得到的硝酸铝晶体较纯净,所用的X物质可以是BC(填编号).
A.氨水 B.铝 c.氢氧化铝 D.偏铝酸钠
(6)该实验室制法与工业上制法相比,其缺点是产生大量污染性气体NO等.
(7)称取7.392g硝酸铝晶体样品,加热灼烧使其分解完全,最终得到1.020gAl2O3,计算硝酸铝晶体样品中结晶水的数目为8.7.
12.X、Y、Z、W均为短周期元素,且原子序数依次增大,X的单质为密度最小的气体,Y的原子最外层电子数是其周期数的三倍,Z与 X的原子最外层电子数相同,Y与 W的原子最外层电子数相同. 下列叙述正确的是( )
| A. | X、Y和 Z的原子半径大小顺序为 Y>Z>X | |
| B. | Z和 Y组成的化合物中一定既有离子键又有共价键. | |
| C. | 元素 X、Y、W各自最高和最低化合价的代数和分别为 0、4、4 | |
| D. | 同时含有 X、Y、Z、W四种元素的两种不同化合物能相互反应 |
9.下列有关分子晶体熔点的高低叙述中,正确的是( )
| A. | H2O<HF | B. | SiCl4>CCl4 | C. | HCl>HF | D. | N2>CO |
16.A、B、C、D、E是同周期的五种主族元素.A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A;C和D的最高价氧化物对应的水化物均呈酸性,且酸性C>D,E是这五种元素中简单离子半径最小的元素,它们的原子序数由小到大的顺序是( )
| A. | B<A<D<C<E | B. | E<B<A<D<C | C. | B<A<E<D<C | D. | E<D<C<B<A |
13.NA代表阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 78g过氧化钠中存在的共价价键总数为2NA | |
| B. | 22.4L(标准状况)氯气充分参与化学反应,转移的电子数不一定为2NA | |
| C. | 1 L0.1 mol•L-1的NaHS溶液中HS-、S2-和H2S粒子数之和小于0.1NA | |
| D. | 一定条件下,密闭容器中2molSO2与1molO2充分反应,产物的分子数为2NA |
14.下列说法正确的是( )
| A. | IA族元素的电负性从上到下逐渐减小,而ⅦA族元素的第一电离能从上到下逐渐增大 | |
| B. | 氢原子中只有一个电子,故氢原子只有一个原子轨道 | |
| C. | 电负性的大小可以作为衡量元素的金属性和非金属性强弱的量度 | |
| D. | NaH的存在不能支持可将氢元素放在ⅦA的观点 |