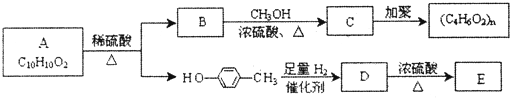
题目内容
能正确表示下列反应的离子方程式是( )
| A、Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O |
| B、NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O |
| C、向澄清石灰水中通入少量CO2:OH-+CO2=HCO3- |
| D、1mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积均匀混合:2AlO2-+5H+=Al(OH)3↓+Al3++H2O |
考点:离子方程式的书写
专题:
分析:A.二者反应生成硝酸铁、NO和水;
B.二者反应生成碳酸钡、一水合氨和水;
C.二者反应生成碳酸钙和水;
D.二者以2:5反应生成氢氧化铝和氯化铝.
B.二者反应生成碳酸钡、一水合氨和水;
C.二者反应生成碳酸钙和水;
D.二者以2:5反应生成氢氧化铝和氯化铝.
解答:
解:A.二者反应生成硝酸铁、NO和水,离子方程式为3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O,故A错误;
B.二者反应生成碳酸钡、一水合氨和水,离子方程式为HCO3-+Ba2++NH4++2OH-=BaCO3↓+H2O+NH3.H2O,故B错误;
C.二者反应生成碳酸钙和水,离子方程式为2OH-+CO2=CO32-+H2O,故C错误;
D.二者以2:5反应生成氢氧化铝、氯化铝和水,离子方程式为2AlO2-+5H+=Al(OH)3↓+Al3++H2O,故D正确;
故选D.
B.二者反应生成碳酸钡、一水合氨和水,离子方程式为HCO3-+Ba2++NH4++2OH-=BaCO3↓+H2O+NH3.H2O,故B错误;
C.二者反应生成碳酸钙和水,离子方程式为2OH-+CO2=CO32-+H2O,故C错误;
D.二者以2:5反应生成氢氧化铝、氯化铝和水,离子方程式为2AlO2-+5H+=Al(OH)3↓+Al3++H2O,故D正确;
故选D.
点评:本题考查离子方程式正误判断,明确物质的性质及离子方程式书写规则即可解答,注意A中亚铁离子能被硝酸氧化,注意B中反应物量之间的关系式,知道D中偏铝酸钠转化为氢氧化铝、氯化铝时偏铝酸钠和HCl的关系,这些都是易错点.

练习册系列答案
相关题目
下列说法中错误的是( )
| A、石油只含碳、氢两种元素,是多种烃的混合物 |
| B、石油经分馏得到的各馏分仍是多种烃的混合物 |
| C、石油裂解的主要目的是获得不饱和烃 |
| D、裂化汽油里含有不饱和烃,不宜用作卤素的萃取剂 |
NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、标准状况下,22.4 L三氧化硫含有的分子数为NA |
| B、39克过氧化钠与足量的二氧化碳反应转移的电子数为NA |
| C、常温常压下,28克乙烯和环丙烷的混合气体中含有的碳原子数为2 NA |
| D、某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
用NA表示阿伏加德罗常数,下列说法正确的是( )
| A、0.1mol的2H35Cl分子中的中子数是2NA |
| B、1mol乙醇所含的羟基的电子数是9NA |
| C、在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA |
| D、将2.24L(标准状况下)CO2通入1L 0.15mol/L的NaOH溶液中,所得CO32-和HCO3-物质的量均为0.05NA |
已知酸性:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2.下列有关离子反应或离子方程式的叙述中,正确的是( )
| A、能使pH试纸显深红色的溶液中,Fe3+、Cl-、Ba2+、Br-能大量共存 |
| B、向溴水中加入足量氯化亚铁溶液能使溴水变成无色 |
| C、向NaClO溶液中通入少量二氧化碳的离子方程式:2ClO-+CO2+H2O═2HClO+CO32- |
| D、向FeI2溶液中滴加少量氯水,反应的离子方程式为:2Fe2++Cl2═2Fe3++2Cl- |
目前人类已发现几千万种物质,对物质进行分类,有利于我们的学习,下列物质的分类不正确的是( )
| A、SO2(氧化物) |
| B、稀硫酸(电解质) |
| C、HNO3(含氧酸) |
| D、氯水(混合物) |
a mol H2和2a mol氦气具有相同的( )
| A、分子数 | B、原子数 |
| C、质子数 | D、质量 |
下列说法中错误的是( )
| A、用元素分析仪确定物质中是否含有C、H、O、N、S、Cl、Br等元素 |
| B、焰色反应能用来鉴别所有金属元素 |
| C、用原子吸收光谱确定物质中含有哪些金属元素 |
| D、层析法利用了混合物中各物质被吸附性能的不同 |
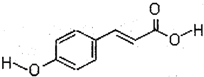 [化学一选修/有机化学基础]
[化学一选修/有机化学基础]