题目内容
17.1摩尔丙烷在光照情况下,最多可以与几摩尔氯气发生取代反应( )| A. | 4mol | B. | 8mol | C. | 10mol | D. | 2mol |
分析 1molC3H8中含有8molH原子,丙烷和氯气发生取代反应时,H原子和Cl2的物质的量之比为1:1,据此计算消耗氯气的物质的量.
解答 解:1molC3H8中含有8molH原子,丙烷和氯气发生取代反应时,H原子和Cl2的物质的量之比为1:1,所以8molH原子完全被取代最多消耗氯气8mol,
故选B.
点评 本题以丙烷和氯气发生取代反应为载体考查物质的量的计算,侧重考查分析、计算能力,明确氯气和H原子物质的量之间关系是解本题关键,题目难度不大.

练习册系列答案
相关题目
7.现有下列三个氧化还原反应:
①2B-+Z2=B2+2Z-②2A2++B2=2A3++2B-③2XO4-+10Z-+16H+=2X2++5Z2+8H2O
根据上述反应,判断下列结论中错误的是( )
①2B-+Z2=B2+2Z-②2A2++B2=2A3++2B-③2XO4-+10Z-+16H+=2X2++5Z2+8H2O
根据上述反应,判断下列结论中错误的是( )
| A. | 要除去含有 A2+、Z-和B-混合溶液中的A2+,而不氧化Z-和B-,应加入Z2 | |
| B. | 还原性强弱顺序为:A2+>B->Z->X2+ | |
| C. | X2+是 XO4- 的还原产物,B2是 B-的氧化产物 | |
| D. | 在溶液中可能发生反应:XO4-+5 A2++8H+=X2++5A3++4H2O |
12. 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图.下列说法正确的是( )
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图.下列说法正确的是( )
 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图.下列说法正确的是( )
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图.下列说法正确的是( )| A. | 溶液中OH-、导线中的电子都向电极a移动 | |
| B. | N2在正极生成 | |
| C. | 反应消耗的NH3与O2的物质的量之比为4:3 | |
| D. | 电极b的反应式为O2+4H++4e-=2H2O |
2.硝基苯是医药和染料的中间体,还是有机溶剂.反应流程、装置如下.

制备硝基苯时还可能发生下列副反应:

有关数据如下表
(1)制备硝基苯的反应式C6H6+HNO3$→_{50-60℃}^{浓硫酸}$C6H5NO2+H2O;
(2)步骤①配置混酸:取100 mL烧杯,用20mL浓硫酸与18mL浓硝酸配置混合酸,操作是:在烧杯中先加入18mL浓硝酸,再沿烧杯壁注入20mL浓硫酸,并不断搅拌、冷却;把配好的混合酸加入恒压漏斗中;最后在三颈烧瓶中加入18mL苯.
(3)在室温下向三颈瓶中的苯中逐滴加入混酸,边滴边搅拌,混合均匀、加热.上图中的加热方式称为水浴加热;反应温度控制在50~60℃的原因是减少(或防止)副反应发生或减少硝酸分解.
硝基苯的提纯步骤为:

(4)步骤⑤表明混合物中有苯和硝基苯的操作和现象是混合物倒入蒸馏水中,液体分为三层.
(5)验证步骤⑥中液体已洗净的操作和现象是:取最后一次洗涤液,向溶液中加入氯化钙溶液,有白色沉淀生成,说明洗涤干净;为了得到更纯净的硝基苯,还须向液体中加入无水CaCl2除去水,然后蒸馏(填操作名称).
(6)设计实验证明“粗产品2”中含二硝基苯测定粗产品的密度大于1.205g•cm-3.
(7)用铁粉、稀盐酸与硝基苯(用Ph-NO2表示)反应可生成染料中间体苯胺(Ph-NH2),其反应的化学方程式为Ph-NO2+3Fe+6HCl→Ph-NH2+3FeCl2+2H2O.

制备硝基苯时还可能发生下列副反应:

有关数据如下表
| 物质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/g•cm-3 | 水溶性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶 |
| 1,3-二硝基苯 | 89 | 301 | 1.57 | 微溶 |
(2)步骤①配置混酸:取100 mL烧杯,用20mL浓硫酸与18mL浓硝酸配置混合酸,操作是:在烧杯中先加入18mL浓硝酸,再沿烧杯壁注入20mL浓硫酸,并不断搅拌、冷却;把配好的混合酸加入恒压漏斗中;最后在三颈烧瓶中加入18mL苯.
(3)在室温下向三颈瓶中的苯中逐滴加入混酸,边滴边搅拌,混合均匀、加热.上图中的加热方式称为水浴加热;反应温度控制在50~60℃的原因是减少(或防止)副反应发生或减少硝酸分解.
硝基苯的提纯步骤为:

(4)步骤⑤表明混合物中有苯和硝基苯的操作和现象是混合物倒入蒸馏水中,液体分为三层.
(5)验证步骤⑥中液体已洗净的操作和现象是:取最后一次洗涤液,向溶液中加入氯化钙溶液,有白色沉淀生成,说明洗涤干净;为了得到更纯净的硝基苯,还须向液体中加入无水CaCl2除去水,然后蒸馏(填操作名称).
(6)设计实验证明“粗产品2”中含二硝基苯测定粗产品的密度大于1.205g•cm-3.
(7)用铁粉、稀盐酸与硝基苯(用Ph-NO2表示)反应可生成染料中间体苯胺(Ph-NH2),其反应的化学方程式为Ph-NO2+3Fe+6HCl→Ph-NH2+3FeCl2+2H2O.
9. 双烯雌酚是人工合成的雌激素化合物,其结构简式如图,下列说法不正确的是( )
双烯雌酚是人工合成的雌激素化合物,其结构简式如图,下列说法不正确的是( )
 双烯雌酚是人工合成的雌激素化合物,其结构简式如图,下列说法不正确的是( )
双烯雌酚是人工合成的雌激素化合物,其结构简式如图,下列说法不正确的是( )| A. | 分子式为C18H18O2,可溶于氯仿或氢氧化钠溶液 | |
| B. | 双烯雌酚既可发生加聚反应,也可以发生缩聚反应 | |
| C. | 其苯环上的二氯代物有7种 | |
| D. | 1 mol双烯雌酚跟H2反应,最多可消耗8mol H2. |
5.硫代硫酸钠是一种常见的化工原料.将SO2通入按一定比例配成的Na2S和Na2CO3的混合溶液中,便可得到Na2S2O3,该反应的化学方程式为2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2.
(1)在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,其目的是_赶走水中的溶解氧(或空气)_.
(2)用该方法获得的Na2S2O3•5H2O晶体中常混有一定量的杂质.某兴趣小组欲对其中所含杂质的成分进行探究(不考虑副反应和杂质所带的结晶水).
【提出假设】假设1:晶体中只含Na2CO3杂质; 假设2:晶体中只含Na2S杂质;
假设3:晶体中含Na2S和Na2CO3两种杂质.
【查阅资料】①SO2+2H2S═3S↓+2H2O;
②Na2S2O3在中性、碱性溶液中较稳定,而在酸性溶液中能迅速反应:
Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O.
③H2S+CuSO4═CuS↓(黑色)+H2SO4
【判断与思考】某同学取少量制得的晶体溶于足量稀H2SO4中,并将产生的气体通入CuSO4溶液中,未见黑色沉淀,据此认为假设2不成立.你认为其结论是否合理?不合理(填“合理”或“不合理”),请说明理由:Na2S2O3与稀H2SO4反应生成的SO2和H2S发生反应,可能无H2S逸出.
【设计方案进行实验】基于假设1,完成下表中的实验方案、现象及结论(仪器自选).限选实验试剂:3mol•L-1 H2SO4溶液、1mol•L-1 NaOH溶液、酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水.
(3)已知:2Na2S2O3+I2═2NaI+Na2S4O6.为测定所制得晶体的纯度,该小组以淀粉作指示剂,用0.010mol•L-1的碘水进行多次取样滴定,测得Na2S2O3•5H2O的含量约为102%.若所用试剂及操作均无不当,产生该结果最可能的原因是晶体中含有杂质(如Na2S等)在滴定时参与反应或晶体部分失去结晶水.
(1)在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,其目的是_赶走水中的溶解氧(或空气)_.
(2)用该方法获得的Na2S2O3•5H2O晶体中常混有一定量的杂质.某兴趣小组欲对其中所含杂质的成分进行探究(不考虑副反应和杂质所带的结晶水).
【提出假设】假设1:晶体中只含Na2CO3杂质; 假设2:晶体中只含Na2S杂质;
假设3:晶体中含Na2S和Na2CO3两种杂质.
【查阅资料】①SO2+2H2S═3S↓+2H2O;
②Na2S2O3在中性、碱性溶液中较稳定,而在酸性溶液中能迅速反应:
Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O.
③H2S+CuSO4═CuS↓(黑色)+H2SO4
【判断与思考】某同学取少量制得的晶体溶于足量稀H2SO4中,并将产生的气体通入CuSO4溶液中,未见黑色沉淀,据此认为假设2不成立.你认为其结论是否合理?不合理(填“合理”或“不合理”),请说明理由:Na2S2O3与稀H2SO4反应生成的SO2和H2S发生反应,可能无H2S逸出.
【设计方案进行实验】基于假设1,完成下表中的实验方案、现象及结论(仪器自选).限选实验试剂:3mol•L-1 H2SO4溶液、1mol•L-1 NaOH溶液、酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水.
| 实验方案 | 现象及结论 |
6.下列有关化学用语表示正确的是( )
| A. | 聚丙烯的链节:-CH2CH(CH3)- | B. | 乙酸的分子式:CH3COOH | ||
| C. | 对硝基苯酚的结构简式: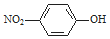 | D. | H2S的电子式: |