题目内容
7.现有下列三个氧化还原反应:①2B-+Z2=B2+2Z-②2A2++B2=2A3++2B-③2XO4-+10Z-+16H+=2X2++5Z2+8H2O
根据上述反应,判断下列结论中错误的是( )
| A. | 要除去含有 A2+、Z-和B-混合溶液中的A2+,而不氧化Z-和B-,应加入Z2 | |
| B. | 还原性强弱顺序为:A2+>B->Z->X2+ | |
| C. | X2+是 XO4- 的还原产物,B2是 B-的氧化产物 | |
| D. | 在溶液中可能发生反应:XO4-+5 A2++8H+=X2++5A3++4H2O |
分析 ①2B-+Z2═B2+2Z-中,Z元素的化合价降低,B元素的化合价升高;
②2A2++B2═2A3++2B-中,A元素的化合价升高,B元素的化合价降低;
③16H++10Z-+2XO4-═2X2++5Z2+8H2O中,Z元素的化合价升高,X元素的化合价降低,结合氧化还原反应基本概念及氧化剂的氧化性大于氧化产物的氧化性、还原剂的还原性大于还原产物的还原性来解答.
解答 解:A.①2B-+Z2═B2+2Z-,氧化性:Z2>B2,
②2A2++B2═2A3++2B-,氧化性:B2>A3+,
③16H++10Z-+2XO4-═2X2++5Z2+8H2O,氧化性:XO4->Z2,
所以氧化性关系为:XO4->Z2>B2>A3+,所以要除去含有A2+、Z-和B-混合溶液中的A2+,而不氧化Z-和B-,应加入B2,故A错误;
B.由氧化性越强,对应离子的还原性越弱,由A可知氧化性关系为:XO4->Z2>B2>A3+,则还原性由强到弱的顺序是 A2+>B->Z->X2+,故B正确;
C.反应③16H++10Z-+2XO4-═2X2++5Z2+8H2O中,X元素化合价降低,被还原,则X2+是XO4- 的还原产物,①2B-+Z2=B2+2Z-,B元素化合价升高,被氧化,则B2是B-的氧化产物,故C正确;
D.由A可知氧化性关系为:XO4->Z2>B2>A3+,则在溶液中可能发生反应:XO4-+5 A2++8H+=X2++5A3++4H2O,故D正确;
故选A.
点评 本题考查氧化还原反应中氧化性的比较及相关的基本概念,明确反应中元素的化合价变化及氧化性比较方法为解答的关键,题目难度不大.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
18.表是元素周期表的一部分,回答下列问题:
(1)元素②的名称为氮,元素⑧的符号为Si.
(2)上述元素中,非金属性最强的元素符号为F,酸性最强的最高价氧化物对应的水化物的化学式为HClO4,能形成两性氢氧化物的元素的符号为Al.
(3)从⑤到⑪的元素中,原子半径最小的元素的符号为Cl.
(4)设计实验证明⑤的单质活动性比⑥的单质活动性强(简述操作过程、现象和结论)将少量Na和Mg分别投入冷水中,金属Na能与水发生剧烈反应,而金属镁反应缓慢,说明Na比Mg活泼.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | O |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑫ | ⑬ |
(2)上述元素中,非金属性最强的元素符号为F,酸性最强的最高价氧化物对应的水化物的化学式为HClO4,能形成两性氢氧化物的元素的符号为Al.
(3)从⑤到⑪的元素中,原子半径最小的元素的符号为Cl.
(4)设计实验证明⑤的单质活动性比⑥的单质活动性强(简述操作过程、现象和结论)将少量Na和Mg分别投入冷水中,金属Na能与水发生剧烈反应,而金属镁反应缓慢,说明Na比Mg活泼.
15.2016年冬季,我省多次出现大范围雾霾天气.下列防止雾霾产生的措施中,不可行的是( )
| A. | 停止冬季供暖,减少有害物质排放 | |
| B. | 对锅炉和汽车等产生的有害气体和烟尘进行处理 | |
| C. | 退耕还林,改善生态环境 | |
| D. | 寻找新能源,减少化石燃料的使用 |
2.一定条件下,在三个容积均为2L的恒容密闭容器中发生反应:H2(g)+CO2(g)?HCOOH(g).下列说法正确的是( )
| 容器编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | |
| H2 | CO2 | HCOOH | |||
| Ⅰ | 150 | 0.4 | 0.4 | 0.2 | 2 |
| Ⅱ | 150 | 0.8 | 0.8 | t1 | |
| Ⅲ | 0.4 | 0.4 | 0.16 | t2 | |
| A. | 反应达到平衡时,容器Ⅰ中的平均反应速率为v(H2)=0.1mol/(L•min) | |
| B. | 反应达到平衡时,容器Ⅱ所需时间t2<2min | |
| C. | 若只改变一个反应条件,容器Ⅲ可能是加入了合适的催化剂 | |
| D. | 起始时,向容器Ⅱ中充入0.45mol H2、0.20mol CO2和0.18molHCOOH,则反应向正反应方向进行 |
17.1摩尔丙烷在光照情况下,最多可以与几摩尔氯气发生取代反应( )
| A. | 4mol | B. | 8mol | C. | 10mol | D. | 2mol |
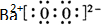 (写电子式).
(写电子式).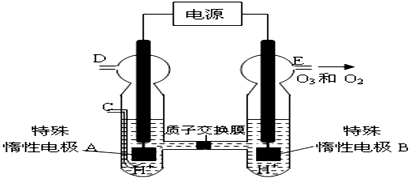
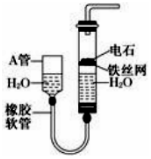 如图,图中的实验装置可用于制取乙炔.
如图,图中的实验装置可用于制取乙炔. 太阳能电池的发展已经进入了第三代.第三代就是铜铟镓硒CIGS等化合物薄膜太阳能电池以及薄膜硅系太阳能电池.完成下列填空:
太阳能电池的发展已经进入了第三代.第三代就是铜铟镓硒CIGS等化合物薄膜太阳能电池以及薄膜硅系太阳能电池.完成下列填空: