题目内容
20.下列有关电解质溶液的说法正确的是( )| A. | 向0.1 mol•L-1CH3COOH溶液中加入少量水,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$减小 | |
| B. | 在0.l mol•L-1的稀硫酸加水稀释的过程中,c(H+):c(SO42-)始终为2:1 | |
| C. | 向盐酸中加入氨水至中性,溶液中$\frac{c(N{H}_{4}^{+})}{c(c{l}^{-})}$>1 | |
| D. | 在含0.1mol NaHSO4溶液中:c(H+)=c(SO42-)+c(OH-) |
分析 A.加水稀释促进CH3COOH 的电离;
B.在0.l mol•L-1的稀硫酸加水稀释的过程中,c(SO42-)始终减小,c(H+)先减小,后不变;
C.根据电荷守恒分析;
D.NaHSO4溶液中电荷守恒为c(H+)+c(Na+)=2c(SO42-)+c(OH-),溶液中c(Na+)=c(SO42-),据此分析.
解答 解:A.加水稀释促进CH3COOH 的电离,n(H+)增大,n(CH3COOH),则溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$增大,故A错误;
B.在0.l mol•L-1的稀硫酸加水稀释的过程中,c(SO42-)始终减小,c(H+)先减小,后不变,所以c(H+):c(SO42-)开始时为2:1,后来逐渐大于2:1,故B错误;
C.向盐酸中加入氨水至中性,溶液中电荷守恒为:c(H+)+c(NH4+)=c(Cl-)+c(OH-),溶液显中性,则c(H+)=c(OH-),所以c(NH4+)=c(Cl-),即溶液中$\frac{c(N{H}_{4}^{+})}{c(c{l}^{-})}$=1,故C错误;
D.NaHSO4溶液中电荷守恒为c(H+)+c(Na+)=2c(SO42-)+c(OH-),溶液中c(Na+)=c(SO42-),所以c(H+)=c(SO42-)+c(OH-),故D正确.
故选D.
点评 本题考查弱电解质的电离、离子浓度大小比较,题目难度中等,注意把握影响弱电解质电离平衡的因素、溶液中电荷守恒关系的应用.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案
相关题目
10.有关合成氨工业的说法中,正确的是( )
| A. | 从合成塔出来的混合气体,其中NH3只占15%,所以合成氨工厂的效率都很低 | |
| B. | 由于氨易液化,N2、H2是循环使用,所以总体来说氨的产率很高 | |
| C. | 合成氨工业的反应温度控制在500℃左右,目的是使化学平衡向正反应方向移动 | |
| D. | 合成氨工厂采用的压强是2×107~5×107Pa,因为在该压强下铁触媒的活性最大 |
11.无水氯化铝是一种重要的催化剂,工业上由Al2O3制备无水氯化铝的反应为2Al2O3(s)+6Cl2(g)$\frac{\underline{\;高温\;}}{\;}$4AlCl3(g)+3O2(g)△H>0.下列分析错误的是( )
| A. | 增大反应体系的压强,反应速率增大 | |
| B. | 加入碳粉,平衡向右移动,原因是碳与O2反应,降低了生成物的浓度且放出热量 | |
| C. | 电解熔融的Al2O3和AlCl3均能得到单质铝 | |
| D. | 升高温度,反应的平衡常数将增大 |
8.下列实验操作中有错误的是( )
| A. | 、分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| B. | 在分液漏斗中进行萃取操作时应该边振荡边放气 | |
| C. | 蒸馏操作时,使用的冷凝水应该由低往高流,形成逆流 | |
| D. | 过滤时,用玻璃棒轻轻搅拌以加速过滤 |
15.已知:2H2O2(l)═2H2O(l)+O2(g)△H=-98kJ•mol-1.在含少量I-的溶液中,H2O2分解反应过程为:
i.H2O2(l)+I-(aq)═H2O(l)+IO-(aq)△H1
ii.H2O2(l)+IO-(aq)═H2O(l)+O2(g)+I-(aq)△H2
下列说法不正确的是( )
i.H2O2(l)+I-(aq)═H2O(l)+IO-(aq)△H1
ii.H2O2(l)+IO-(aq)═H2O(l)+O2(g)+I-(aq)△H2
下列说法不正确的是( )
| A. | △H1+△H2=△H | |
| B. | I-是H2O2分解反应的催化剂 | |
| C. | 欲分解2 mol H2O2(l),至少需要提供98 kJ的热量 | |
| D. | 若生成1 mol O2,则反应ii转移电子的物质的量为2 mol |
5.下列各项除杂所用方法正确的是( )
| A. | KCl固体混有KClO3:加少量二氧化锰固体并加热 | |
| B. | CO2中混有CO气体:通入氧气中点燃 | |
| C. | 硝酸钾溶液中混有氯化钠:加入四氯化碳萃取并分液 | |
| D. | Cu(NO3)2溶液混有AgNO3:加入过量的铜粉并过滤 |
12. 目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
请回答下列问题:
(1)反应②是吸热(填“吸热”或“放热”)反应.
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1×K2 (用K1、K2表示),
△H3═△H1+△H2 (用△H1、△H2表示);根据反应③判断△S<0(填“>”、“=”或“<”),在较低(填“较高”或“较低”)温度下有利于该反应自发进行.
(3)要使反应③在一定条件下建立的平衡正向移动,可采取的措施有ADF(填写字母序号).
A.缩小反应容器的容积 B.扩大反应容器的容积 C.升高温度
D.降低温度 E.使用合适的催化剂 F.从平衡体系中及时分离出CH3OH
(4)500°C时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1mol•L-1、0.3mol•L-1、0.3mol•L-1、0.15mol•L-1,则此时v正<v逆(填“>”、“=”或“<”).
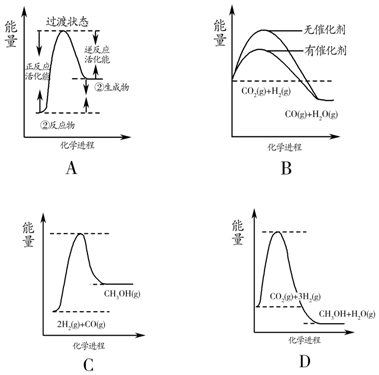
(5)根据表格测得焓变,下列能量关系图合理的是AD.
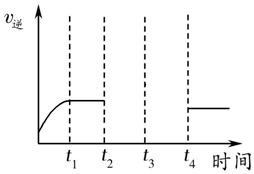
(6)某兴趣小组研究反应②的逆反应速率在下列不同条件下随时间的变化曲线,开始时升温,t1时平衡,t2时降压,t3时增加CO浓度,t4时又达到平衡.请画出t2至t4的曲线.
 目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
| 化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
| 500 | 700 | 800 | |||
| ①2H2(g)+CO(g)?CH3OH(g) | △H1 | K1 | 2.5 | 0.34 | 0.15 |
| ②CO2(g)+H2(g)?CO(g)+H2O(g) | △H2 | K2 | 1.0 | 1.70 | 2.52 |
| ③CO2(g)+3H2(g)?CH3OH(g)+H2O(g) | △H3 | K3 | |||
(1)反应②是吸热(填“吸热”或“放热”)反应.
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1×K2 (用K1、K2表示),
△H3═△H1+△H2 (用△H1、△H2表示);根据反应③判断△S<0(填“>”、“=”或“<”),在较低(填“较高”或“较低”)温度下有利于该反应自发进行.
(3)要使反应③在一定条件下建立的平衡正向移动,可采取的措施有ADF(填写字母序号).
A.缩小反应容器的容积 B.扩大反应容器的容积 C.升高温度
D.降低温度 E.使用合适的催化剂 F.从平衡体系中及时分离出CH3OH
(4)500°C时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1mol•L-1、0.3mol•L-1、0.3mol•L-1、0.15mol•L-1,则此时v正<v逆(填“>”、“=”或“<”).
(5)根据表格测得焓变,下列能量关系图合理的是AD.

(6)某兴趣小组研究反应②的逆反应速率在下列不同条件下随时间的变化曲线,开始时升温,t1时平衡,t2时降压,t3时增加CO浓度,t4时又达到平衡.请画出t2至t4的曲线.
10.下列现象或事实的解释正确的是( )
| A. | Al2O3作耐火材料是因为氧化铝熔点高 | |
| B. | 光导纤维具有很强的导电能力,应用于制造通信光缆 | |
| C. | 过氧化钠用于呼吸面具中是因为过氧化钠是强氧化剂能氧化CO2和水 | |
| D. | FeCl3溶液可用于铜质印刷线路板制作是因为FeCl3能与铜单质发生置换反应 |