题目内容
8.关于1L 0.1mol/L 的(NH4)2Fe(SO4)2溶液,下列说法正确的是( )| A. | Cl-、I-、Na+能在该溶液中大量共存 | |
| B. | 通入H2S气体,发生反应的离子方程式为:H2S+Fe2+═FeS↓+2H+ | |
| C. | Ca2+、ClO-、Cl-、Cu2+能在该溶液中大量共存 | |
| D. | 和少量的NaOH溶液充分反应并加热,可生成标准状况下的NH3 4.48L |
分析 A.Cl-、I-、Na+相互之间不发生反应;.
B.硫化亚铁与稀硫酸反应生成硫化氢和硫酸亚铁;
C.次氯酸根离子具有强氧化性;
D.氢氧化钠少量,先与二价铁子反应.
解答 解:A.Cl-、I-、Na+相互之间不发生反应,能大量共存,故A正确;
B.通入H2S气体,若发生反应的离子方程式为:H2S+Fe2+═FeS↓+2H+,即生成硫酸,而硫酸与硫化亚铁反应,不能共存,故B错误;
C.次氯酸根离子具有强氧化性,能够氧化二价铁离子,不能大量共存,故C错误;
D.氢氧化钠少量,先与二价铁子反应,不会生成氨气,故D错误;
故选:A.
点评 本题考查了离子的共存与化学方程式的书写,明确离子反应发生条件、离子方程式书写注意事项是解题关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.向某无色溶液中加入过量的稀盐酸有沉淀生成,过滤后向滤液中加入过量的纯碱溶液又有沉淀生成,下列溶液中符合此条件的是( )
①Ag+、Fe3+、Na+ ②Ag+、Al3+、K+ ③Ag+、Ba2+、NO3- ④SiO32-、AlO2-、K+⑤Ag+、NH4+、H+ ⑥AlO2-、K+、Al3+.
①Ag+、Fe3+、Na+ ②Ag+、Al3+、K+ ③Ag+、Ba2+、NO3- ④SiO32-、AlO2-、K+⑤Ag+、NH4+、H+ ⑥AlO2-、K+、Al3+.
| A. | ①②④ | B. | ②③④ | C. | ②③④⑥ | D. | ①②③④⑥ |
17.纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和C12反应的化学方程式为4C12+Na2S2O3+5H2O=2NaCl+2H2SO4+6HCl,有关该反应的说法正确的是( )
| A. | 该反应中氧化剂是C12 | B. | 每有1mol C12反应转移1mole- | ||
| C. | 反应中S元素的价态降低 | D. | 该反应中H2O被氧化 |
3.下列叙述中,正确的是( )
| A. | 石油、煤、氢气都属于化石燃料 | B. | 化合反应都是放热反应 | ||
| C. | 分解反应都是吸热反应 | D. | 风能可以转化为电能 |
13.有机物的种类繁多,但其命名是有规则的.下列有机物命名正确的是( )
| A. |  2-乙基丁烷 2-乙基丁烷 | B. | CH3CHBr2二溴乙烷 | ||
| C. |  2-甲基丁烯 2-甲基丁烯 | D. | 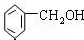 苯甲醇 苯甲醇 |
17.已知某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2.已知该反应中H2O2只发生如下过程:H2O2→O2,则关于该反应体系说法错误的是( )
| A. | 该反应的化学方程式为2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O | |
| B. | 该反应中的氧化剂是H2O2,还原产物是O2 | |
| C. | 氧化性:H2CrO4>O2 | |
| D. | 如反应转移了0.3 rnol电子,则产生的气体在标准状况下体积为3.36 L |
18.对下列各溶液中,微粒的物质的量浓度关系表述正确的是( )
| A. | 某溶液中存在的离子只有Cl-、OH-、NH4+、H+,该溶液中离子浓度大小关系可能为:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 0.1mol•L-1(NH4)2SO4溶液中:c(H+)>c(NH4+) | |
| C. | 0.1mol•L-1的HCl溶液与0.1mol•L-1的NaOH溶液等体积混合:c(H+)+c(Na+)═c(OH-)+c(Cl-) | |
| D. | 0.1mol•L-1 CH3COONa溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
