题目内容
17.纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和C12反应的化学方程式为4C12+Na2S2O3+5H2O=2NaCl+2H2SO4+6HCl,有关该反应的说法正确的是( )| A. | 该反应中氧化剂是C12 | B. | 每有1mol C12反应转移1mole- | ||
| C. | 反应中S元素的价态降低 | D. | 该反应中H2O被氧化 |
分析 4C12+Na2S2O3+5H2O=2NaCl+2H2SO4+6HCl中,S元素的化合价由+2价升高为+6价,Cl元素的化合价由0降低为-1价,以此来解答.
解答 解:A.Cl元素的化合价由0降低为-1价,被还原,则C12 做氧化剂,故A正确;
B.4C12+Na2S2O3+5H2O=2NaCl+2H2SO4+6HCl中,S元素的化合价由+2价升高为+6价,Cl元素的化合价由0降低为-1价,所以每有1mol C12反应转移2mole-,故B错误;
C.反应中S元素的化合价由+2价升高为+6价,故C错误;
D.反应中H2O中O、H元素的化合价没有变化,则H2O既不被氧化又不被还原,故D错误;
故选A.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,题目难度不大.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案
相关题目
8.多数晶体中的微观微粒服从紧密堆积原理的根本原因是( )
| A. | 便于形成规则的几何外形 | |
| B. | 微观微粒结合得越紧密,体系总能量越低,体系越稳定 | |
| C. | 便于使晶体具有对称性 | |
| D. | 为了使晶体具备各向异性 |
12.A、B、C、D四种短周期元素,0.5molA的元素的离子得到NA个电子后被还原为中性原子;0.4gA的氧化物恰好与100mL0.2mol/L的盐酸完全反应;A元素原子核内质子数与中子数相等.B元素原子核外电子数比A元素原子核外电子数多1;C-离子核外电子层数比A元素的离子核外电子层数多1;D元素与C元素处于同一主族.下列说法正确的是( )
| A. | A元素位于元素周期表的第三周期ⅢA族 | |
| B. | B的单质只能与硫酸反应,不能与氢氧化钠溶液反应 | |
| C. | C的气态氢化物的沸点比D的气态氢化物的沸点高 | |
| D. | D的非金属性比C的非金属性强 |
2.人造地球卫星用到的一种高能电池--银锌蓄电池,其电池的电极反应式为:Zn+Ag2O=ZnO+2Ag,下列说法正确的是( )
| A. | Ag2O 被还原,是负极材料 | |
| B. | 正极增重16 克时电路中有2NA个电子转移 | |
| C. | 用该电池进行电解水试验,每生成标况下aLO2,电池负极增重16a/11.2 克 | |
| D. | 该电池的电解质溶液显酸性 |
9.下列叙述错误的是( )
| A. | 13C和14C属于同一种元素,它们互为同位素 | |
| B. | 1H和2H是不同的核素,它们的质子数相等 | |
| C. | ${\;}_{90}^{230}$Th与${\;}_{90}^{232}$Th互为同素异形体 | |
| D. | ${\;}_{1}^{1}$ H、${\;}_{1}^{2}$ H、${\;}_{1}^{3}$ H、H+、H2是氢元素的五种不同粒子 |
8.关于1L 0.1mol/L 的(NH4)2Fe(SO4)2溶液,下列说法正确的是( )
| A. | Cl-、I-、Na+能在该溶液中大量共存 | |
| B. | 通入H2S气体,发生反应的离子方程式为:H2S+Fe2+═FeS↓+2H+ | |
| C. | Ca2+、ClO-、Cl-、Cu2+能在该溶液中大量共存 | |
| D. | 和少量的NaOH溶液充分反应并加热,可生成标准状况下的NH3 4.48L |
9. 已知25℃时部分弱电解质的电离平衡常数数据如表:
已知25℃时部分弱电解质的电离平衡常数数据如表:
回答下列问题:
(1)物质的量浓度均为0.1mol•L-1的四种溶液:a.CH3COOH b.Na2CO3 c.NaClO
d.NaHCO3; pH由小到大的排列顺序是(填序号)a<d<c<b.
(2)常温下,0.1mol•L-1的CH3COOH溶液加水稀释过程中,
下列表达式的数据变大的是BD.
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)•c(OH-)
D.c(OH-)/c(H+) E.c(H+)•c(CH3COO-)/c(CH3COOH)
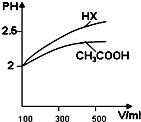
(3)体积均为100ml pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,
则Ka(HX)> Ka(CH3COOH)(填>、<或=).
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中自由离子浓度的从大到小
的关系为c(CH3COO-)>c(Na+)>c(H+)>c(OH-),$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=18.
 已知25℃时部分弱电解质的电离平衡常数数据如表:
已知25℃时部分弱电解质的电离平衡常数数据如表:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol•L-1的四种溶液:a.CH3COOH b.Na2CO3 c.NaClO
d.NaHCO3; pH由小到大的排列顺序是(填序号)a<d<c<b.
(2)常温下,0.1mol•L-1的CH3COOH溶液加水稀释过程中,
下列表达式的数据变大的是BD.
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)•c(OH-)
D.c(OH-)/c(H+) E.c(H+)•c(CH3COO-)/c(CH3COOH)
(3)体积均为100ml pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,
则Ka(HX)> Ka(CH3COOH)(填>、<或=).
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中自由离子浓度的从大到小
的关系为c(CH3COO-)>c(Na+)>c(H+)>c(OH-),$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=18.