题目内容
12.下列关于有机物的说法错误的是( )| A. | CCl4可由CH4制得,可萃取碘水中的碘 | |
| B. | 乙醇与乙酸互为同分异构体 | |
| C. | 二氯甲烷只有一种结构 | |
| D. | 等物质的量的乙醇和乙烯完全燃烧时所需氧气的质量相等 |
分析 A、碘在四氯化碳中的溶解度比在水中的大,且四氯化碳不溶于水;
B、分子式相同而结构不同的化合物互为同分异构体;
C、甲烷为正四面体结构,4个H原子完全相同;
D、1mol乙醇和1mol乙烯燃烧均消耗3mol氧气.
解答 解:A、碘在四氯化碳中的溶解度比在水中的大,且四氯化碳不溶于水,且碘、水和四氯化碳三者间互不反应,故可以用四氯化碳来萃取碘水中的碘,故A正确;
B、分子式相同而结构不同的化合物互为同分异构体,而乙醇和乙酸的分子式不同,故不是同分异构体,故B错误;
C、甲烷为正四面体结构,4个H原子完全相同,故用两个-Cl取代两个-H原子,只有一种取代方式,故二氯甲烷的结构只有一种,故C正确;
D、1mol乙醇和1mol乙烯燃烧均消耗3mol氧气,故等物质的量的乙醇和乙烯燃烧时的耗氧量相同,故D正确.
故选B.
点评 本题考查了碘的萃取、同分异构体的判断和二氯代物结构的判断以及燃烧耗氧量的分析,难度不大,注意掌握基础.

练习册系列答案
相关题目
2.H、C、N、O、Na、S、Cl是常见的七种短周期元素.
(1)N位于元素周期表第二 周期第ⅤA 族,其基态原子核外有3个未成对电子;S的基态原子核外电子排布式为1s22s22p63s23p4.
(2)用“>”或“<’’填空:
(3)由上述元素中的任意两种元素组成的化合物中,既含极性键又含非极性键的物质有H2O2、N2H4、C2H2、C2H4、C2H6、C6H6等任选其一(任写一种物质的分子式).
(4)NH3可作低温溶剂,它易液化的原因是NH3分子间能形成分子间氢键,氢键的存在使得氨气分子间作用力显著增强,沸点显著升高,易液化.已知25℃、101KPa,NH3能在纯氧中燃烧,每转移1mol e-,放出akJ热量,写出该条件下NH3燃烧的热化学方程式4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-4a kJ/mol.
(5)通常情况下,N2O5为无色晶体,它与Na2O2能发生反应(类似于CO2与Na2O2能反应),写出反应的化学方程式,并用单线桥标出电子转移的方向和数目: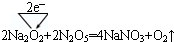 .
.
(1)N位于元素周期表第二 周期第ⅤA 族,其基态原子核外有3个未成对电子;S的基态原子核外电子排布式为1s22s22p63s23p4.
(2)用“>”或“<’’填空:
| 第一电离能 | 电负性 | 稳定性 | 酸性 |
| N>O | C<N | H2S<H2O | H2SO4<HClO4 |
(4)NH3可作低温溶剂,它易液化的原因是NH3分子间能形成分子间氢键,氢键的存在使得氨气分子间作用力显著增强,沸点显著升高,易液化.已知25℃、101KPa,NH3能在纯氧中燃烧,每转移1mol e-,放出akJ热量,写出该条件下NH3燃烧的热化学方程式4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-4a kJ/mol.
(5)通常情况下,N2O5为无色晶体,它与Na2O2能发生反应(类似于CO2与Na2O2能反应),写出反应的化学方程式,并用单线桥标出电子转移的方向和数目:
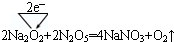 .
.
3.对于下列反应,其中葡萄糖不能发生的是( )
| A. | 酯化 | B. | 氧化 | C. | 加成 | D. | 水解 |
20.以下物质间的每步转化通过一步反应就能实现的是( )
| A. | H2SiO3$\stackrel{△}{→}$SiO2$\stackrel{HCl(aq)}{→}$SiCl4 | |
| B. | S$→_{催化剂/△}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | Ca(ClO)2(aq)$\stackrel{CO_{2}}{→}$HClO(aq)$\stackrel{光照}{→}$HCl(aq) | |
| D. | Fe$→_{△}^{少量Cl_{2}}$FeCl2$\stackrel{NaOH溶液}{→}$Fe(OH)2$\stackrel{空气中放置}{→}$Fe(OH)3 |
7.将a g钾钠合金溶于过量100mL b mol/L的稀盐酸中,将溶液加热蒸干后继续灼烧至质量不变时得固体c g.则放出H2的体积在标准状况下是( )
| A. | 2.24b L | B. | $\frac{c-a}{71}$×22.4L | C. | $\frac{c-a}{17}$×22.4L | D. | $\frac{a-c}{35.5}$×22.4L |
17.从海水中可获得的在常温下为液体的单质是( )
| A. | H2O | B. | K | C. | Br2 | D. | I2 |
4.漂白液的有效成分是( )
| A. | NaCl | B. | NaClO | C. | NaOH |
1.Na2S2O3•5H2O是重要的化工原料.取126.0g Na2SO3,溶于800mL水配成溶液.另取一定量的硫粉加乙醇后和上述溶液混合.小火加热至微沸,反应约1h后过滤.滤液经蒸发、浓缩、冷却至10℃后析出Na2S2O3•5H2O粗晶体.
(1)加入乙醇的目的是加大Na2SO3和硫粉的接触面积,加快反应速率.
(2)若将126.0g Na2SO3反应完全,理论上需要硫粉的质量为32.0g.
(3)滤液中除Na2S2O3和未反应的Na2SO3外,最可能存在的无机杂质是Na2SO4.
(4)为测定所得粗晶体中Na2S2O3•5H2O和Na2SO3比例,现称取三份质量不同的粗晶体,分别加入相同浓度的硫酸溶液30mL,充分反应(Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O)后滤出硫,微热滤液使SO2全部逸出.测得有关实验数据如下表(气体体积已换算为标准状况).
求所用硫酸溶液的物质的量浓度及粗晶体中n(Na2S2O3•5H2O)、n(Na2SO3)的比值.(请写出计算过程).
(1)加入乙醇的目的是加大Na2SO3和硫粉的接触面积,加快反应速率.
(2)若将126.0g Na2SO3反应完全,理论上需要硫粉的质量为32.0g.
(3)滤液中除Na2S2O3和未反应的Na2SO3外,最可能存在的无机杂质是Na2SO4.
(4)为测定所得粗晶体中Na2S2O3•5H2O和Na2SO3比例,现称取三份质量不同的粗晶体,分别加入相同浓度的硫酸溶液30mL,充分反应(Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O)后滤出硫,微热滤液使SO2全部逸出.测得有关实验数据如下表(气体体积已换算为标准状况).
| 第一份 | 第二份 | 第三份 | |
| 样品的质量/g | 6.830 | 13.660 | 30.000 |
| 二氧化硫气体的体积/L | 0.672 | 1.344 | 2.688 |
| 硫的质量/g | 0.800 | 1.600 | 3.200 |
2.硅及其化合物已被广泛用于生产生活中,下列说法中错误的是( )


| A. | 右图是常见于汽车中的小摆件“苹果花”,它的动力是以Si为原料制作的太阳能电池 | |
| B. | 玻璃上的精美刻花,是工艺师用盐酸刻蚀玻璃形成的 | |
| C. | 互联网通过光纤交换信息,光纤的主要原料是SiO2 | |
| D. | 因为玻璃中含有SiO2,所以不能用磨口玻璃塞的试剂瓶盛装碱性溶液 |