题目内容
2.硅及其化合物已被广泛用于生产生活中,下列说法中错误的是( )
| A. | 右图是常见于汽车中的小摆件“苹果花”,它的动力是以Si为原料制作的太阳能电池 | |
| B. | 玻璃上的精美刻花,是工艺师用盐酸刻蚀玻璃形成的 | |
| C. | 互联网通过光纤交换信息,光纤的主要原料是SiO2 | |
| D. | 因为玻璃中含有SiO2,所以不能用磨口玻璃塞的试剂瓶盛装碱性溶液 |
分析 A.“苹果花”的动力是硅太阳能电池;
B.二氧化硅是酸性氧化物与盐酸不反应,工艺师是用氢氟酸精美刻花;
C.光纤的主要成分是SiO2;
D.二氧化硅与氢氧化钠反应生成硅酸钠,硅酸钠是粘合剂.
解答 解:A.小摆件“苹果花”的动力是硅太阳能电池,故A正确;
B.二氧化硅是酸性氧化物与盐酸不反应,工艺师是用氢氟酸精美刻花,而不是盐酸,故B错误;
C.光纤的主要成分是SiO2,故C正确;
D.二氧化硅与氢氧化钠反应生成硅酸钠,硅酸钠是粘合剂,所以不能用磨口玻璃塞的试剂瓶盛装碱性溶液,故D正确;
故选B.
点评 本题考查硅及其化合物的性质,题目难度不大,注意基础知识的积累.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
12.下列关于有机物的说法错误的是( )
| A. | CCl4可由CH4制得,可萃取碘水中的碘 | |
| B. | 乙醇与乙酸互为同分异构体 | |
| C. | 二氯甲烷只有一种结构 | |
| D. | 等物质的量的乙醇和乙烯完全燃烧时所需氧气的质量相等 |
13.在pH均为3的醋酸溶液和稀硫酸中,下列叙述中,相等的是( )
①物质的量浓度
②氢离子浓度
③与足量锌反应时的初始速率
④电离程度
⑤中和等体积的两种酸所需同浓度氢氧化钠溶液的体积
⑥稀释相同倍数后的pH.
①物质的量浓度
②氢离子浓度
③与足量锌反应时的初始速率
④电离程度
⑤中和等体积的两种酸所需同浓度氢氧化钠溶液的体积
⑥稀释相同倍数后的pH.
| A. | ①④ | B. | ②③ | C. | ②④⑥ | D. | ②⑤ |
10.下列叙述中正确的是( )
| A. | 1 mol Na2O2与CO2完全反应时转移电子数为2NA | |
| B. | 标准状况下11.2 L Cl2与4.25 g NH3所含有的原子数 | |
| C. | 标准状况下36 g H2O与1.204×1024个O2分子所占的体积 | |
| D. | 1mol固体NaHCO3所含有的阴阳离子总数为3NA |
17.下列过程或现象与盐类水解无关的是( )
| A. | 用热的纯碱溶液去油污 | |
| B. | pH=3的醋酸溶液,加水稀释10倍后pH<4 | |
| C. | 实验室配置FeCl3溶液时,加入少量稀盐酸,以防止溶液浑浊 | |
| D. | 草木灰与铵态氮肥不能混合施用 |
14. 电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如表所示:
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如表所示:
(1)将浓度为0.1mol•L-1 HF溶液加水稀释一倍(假设温度不变),下列各量增大的是CD.
A.c(H+) B.c(H+)•c(OH-) C.$\frac{c({H}^{+})}{c(HF)}$ D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
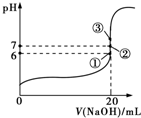
(2)25℃时,在20mL 0.1mol•L-1氢氟酸中加入V mL 0.1mol•L-1 NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是BC.
A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中c(F-)-c(Na+)=9.9×10-7 mol•L-1
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(F-)<c(Na+)=0.1mol•L-1
(3)物质的量浓度均为0.1mol•L-1的下列四种溶液:①Na2CO3溶液;②NaHCO3溶液;③NaF溶液;④NaClO溶液.依据数据判断pH由大到小的顺序是①④②③(或①>④>②>③,用物质名称表示也对),.
(4)Na2CO3溶液显碱性是因为CO32-水解的缘故,请设计简单的实验事实证明之在碳酸钠溶液中滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去或变浅.
(5)长期以来,一直认为氟的含氧酸不存在.1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H-O-F.HFO与水反应得到HF和化合物A,每生成1mol HF转移2mol电子.
 电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如表所示:
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如表所示:| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数(Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
A.c(H+) B.c(H+)•c(OH-) C.$\frac{c({H}^{+})}{c(HF)}$ D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(2)25℃时,在20mL 0.1mol•L-1氢氟酸中加入V mL 0.1mol•L-1 NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是BC.
A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中c(F-)-c(Na+)=9.9×10-7 mol•L-1
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(F-)<c(Na+)=0.1mol•L-1
(3)物质的量浓度均为0.1mol•L-1的下列四种溶液:①Na2CO3溶液;②NaHCO3溶液;③NaF溶液;④NaClO溶液.依据数据判断pH由大到小的顺序是①④②③(或①>④>②>③,用物质名称表示也对),.
(4)Na2CO3溶液显碱性是因为CO32-水解的缘故,请设计简单的实验事实证明之在碳酸钠溶液中滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去或变浅.
(5)长期以来,一直认为氟的含氧酸不存在.1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H-O-F.HFO与水反应得到HF和化合物A,每生成1mol HF转移2mol电子.
11.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述不正确的是( )


| A. | 两烧杯中铜片表面均有气泡产生 | B. | 甲中铜片是正极,锌片是负极 | ||
| C. | 两烧杯中溶液的pH均增大 | D. | 产生气泡的速度甲比乙快 |
