题目内容
已知以下两个氧化还原反应的化学方程式:①Cl2+H2O═HCl+HClO②2Al+Fe2O3
Al2O3+2Fe
(1)用单线桥法表示反应②中的电子转移情况: .
(2)若反应②中每生成1mol Fe,转移电子的物质的量是: .
(3)将反应①改写成离子方程式: .
| ||
(1)用单线桥法表示反应②中的电子转移情况:
(2)若反应②中每生成1mol Fe,转移电子的物质的量是:
(3)将反应①改写成离子方程式:
考点:氧化还原反应
专题:氧化还原反应专题
分析:Fe2O3+3Al
Al2O3+3Fe中Fe元素化合价由+3价降低为0价,被还原,Fe2O3为氧化剂,Al元素化合价由0价升高为+3价,被氧化,为还原剂,反应①中氯气和水反应生成盐酸和次氯酸,其中HClO为弱电解质,以此解答该题.
| ||
解答:
解:(1)Fe2O3+3Al
Al2O3+3Fe中Fe元素化合价降低,被还原,Fe2O3为氧化剂,Al元素化合价升高,被氧化,为还原剂,则Fe得到2×3e-,Al失去2×3e-,
电子转移数目和方向可表示为 ,故答案为:
,故答案为: ;
;
(2)反应中Fe元素化合价由+3价降低到0价,则每生成1mol Fe,转移电子的物质的量是3mol,故答案为:3mol;
(3)氯气和水反应生成盐酸和次氯酸,其中HClO为弱电解质,离子方程式为Cl2+H2O═H++Cl-+HClO,故答案为:Cl2+H2O═H++Cl-+HClO.
| ||
电子转移数目和方向可表示为
 ,故答案为:
,故答案为: ;
;(2)反应中Fe元素化合价由+3价降低到0价,则每生成1mol Fe,转移电子的物质的量是3mol,故答案为:3mol;
(3)氯气和水反应生成盐酸和次氯酸,其中HClO为弱电解质,离子方程式为Cl2+H2O═H++Cl-+HClO,故答案为:Cl2+H2O═H++Cl-+HClO.
点评:本题考查氧化还原反应,侧重于学生的分析能力的考查,为高频考点,注意把握元素化合价的变化,能会用双线桥法表示电子转移的方向和数目,难度不大.

练习册系列答案
相关题目
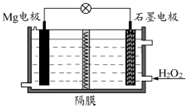 Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )
Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )| A、Mg 电极是该电池的正极 |
| B、H2O2 在石墨电极上发生氧化反应 |
| C、石墨电极上的电极反应式为:H2O2+2e-=2OH- |
| D、导线中电子由正极流向负极,溶液中Cl-向正极移动 |
下列热化学方程式中的△H能表示可燃物的燃烧热的是( )
| A、2H2S(g)+O2(g)=2S (s)+2H2O(l)△H=-Q2 kJ/mol | ||
| B、CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-802.3kJ/mol | ||
C、CO(g)+
| ||
| D、2H2(g)+O2(g)═2H2O(1);△H=-571.6kJ/mol |
X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族,其中只有两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9,单质Y可与NaOH溶液反应生成氢气.下列说法不正确的是( )
| A、原子半径:Y>Z>W |
| B、XW2熔点为107℃,沸点为142.5℃,说明固态XW2为分子晶体 |
| C、电解YW3固体可得单质Y |
D、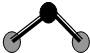 ZW2分子结构见右图,说明ZW2是极性分子 |
有BaCl2和NaCl的混合溶液a L,将它均分成两份.一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀.反应中消耗xmolH2SO4、y mol AgNO3.据此得知原混合溶液中的c(Na+)/mol?L-1为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列说法正确的是( )
| A、常温下,反应2A (s)+B (g)=2C (g)+D (g)不能自发进行,则该反应△H一定大于0 |
| B、铜的金属活动性比铁弱,可在海轮外壳上装若干铜块以减缓船体的腐蚀速率 |
| C、其他条件不变,向纯水中加入盐酸或氢氧化钠都能抑制水的电离,降低水的离子积 |
| D、能与酸反应的氧化物,一定是碱性氧化物 |
 用试纸检验气体性质是一种重要的实验方法.如图所示的实验中(可加热),下列试纸的选用、现象、对应结论都正确的一项是( )
用试纸检验气体性质是一种重要的实验方法.如图所示的实验中(可加热),下列试纸的选用、现象、对应结论都正确的一项是( )