题目内容
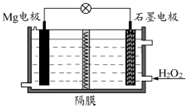 Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )
Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )| A、Mg 电极是该电池的正极 |
| B、H2O2 在石墨电极上发生氧化反应 |
| C、石墨电极上的电极反应式为:H2O2+2e-=2OH- |
| D、导线中电子由正极流向负极,溶液中Cl-向正极移动 |
考点:化学电源新型电池
专题:电化学专题
分析:该装置中Mg易失电子作负极,电极反应式为Mg-2e-=Mg2+,H2O2具有氧化性,应为原电池的正极,被还原,电极反应式为H2O2+2e-═2OH-,据此分析解答.
解答:
解:A.Mg易失电子发生氧化反应而作负极,故A错误;
B.H2O2在石墨电极上得电子发生还原反应生成氢氧根离子,其电极反应式:H2O2+2e-═2OH-,故B错误;
C.H2O2在石墨电极上得电子发生还原反应生成氢氧根离子,其电极反应式:H2O2+2e-═2OH-,故C正确;
D.导线中电子由负极流向正极放电时,氯离子向负极移动,即向Mg电极移动,故D错误;
故选C.
B.H2O2在石墨电极上得电子发生还原反应生成氢氧根离子,其电极反应式:H2O2+2e-═2OH-,故B错误;
C.H2O2在石墨电极上得电子发生还原反应生成氢氧根离子,其电极反应式:H2O2+2e-═2OH-,故C正确;
D.导线中电子由负极流向正极放电时,氯离子向负极移动,即向Mg电极移动,故D错误;
故选C.
点评:本题考查了原电池原理,由Mg、双氧水的性质确定正负极,会正确书写电极反应式,知道离子移动方向,题目难度不大.

练习册系列答案
相关题目
下列关于杂化轨道的叙述中,不正确的是( )
| A、分子中中心原子通过sp2杂化轨道成键时,该分子不一定为平面三角形结构 |
| B、杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子 |
| C、N2分子中N原子没有杂化,分子中有1个σ键、2个π键 |
| D、H2SO4分子中三种原子均以杂化轨道成键 |
下列说法全部正确的是( )
①CH3-CH=CH2和CH2=CH2的最简式相同;
②CH≡CH和C6H6含碳量相同;
③苯乙烯和丁烯为同系物;
④正戊烷、异戊烷、新戊烷的沸点逐渐变低;
⑤标准状况下,11.2L的戊烷所含的分子数为0.5NA (NA为阿伏加德罗常数)
①CH3-CH=CH2和CH2=CH2的最简式相同;
②CH≡CH和C6H6含碳量相同;
③苯乙烯和丁烯为同系物;
④正戊烷、异戊烷、新戊烷的沸点逐渐变低;
⑤标准状况下,11.2L的戊烷所含的分子数为0.5NA (NA为阿伏加德罗常数)
| A、①②③ | B、②③④ |
| C、①②④ | D、③④⑤ |
下列变化过程不必利用催化剂的是( )
| A、NH3+O2→NO |
| B、CH4→CH3Cl |
C、 +H2→ +H2→ |
| D、C6H12O6→C2H5OH |
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生.下列属于未来新能源标准的是( )
①太阳能 ②生物质能 ③风能 ④氢能 ⑤煤 ⑥石油 ⑦天然气 ⑧核能.
①太阳能 ②生物质能 ③风能 ④氢能 ⑤煤 ⑥石油 ⑦天然气 ⑧核能.
| A、①②③④ | B、⑤⑥⑦⑧ |
| C、①②③④⑧ | D、①③④⑦⑧ |
已知1.2g C(石墨)不完全燃烧生成CO,放出11.1kJ热量,继续燃烧又放出28.3kJ热量.则能表示C(石墨)燃烧热的热化学方程式为( )
A、C(石墨)+
| ||
| B、C(石墨)+O2(g)═CO(g);△H=-111.1kJ?mol-1 | ||
| C、C(石墨)+O2(g)═CO2(g);△H=-394kJ?mol-1 | ||
| D、C(石墨)+O2(g)═CO2(g);△H=-28.3kJ?mol-1 |