题目内容
15.下列各溶液中,微粒的物质的量浓度关系不正确的是( )| A. | 1.0mol/L Na2CO3溶液:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| B. | 1.0mol/L Na2CO3溶液:c(H2CO3)+c(HCO3-)+c(CO32-)+C(Na+)=3.0mol/L | |
| C. | 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-) | |
| D. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
分析 A.根据碳酸钠溶液中的电荷守恒判断;
B.根据碳酸钠溶液中的物料守恒分析;
C.钠离子和硝酸根离子不发生水解,根据物料守恒分析;
D.溶液呈酸性,则c(H+)>c(OH-),再根据电荷守恒判断钠离子和醋酸根离子浓度大小.
解答 解:A.1.0mol/L Na2CO3溶液中,根据电荷守恒可得:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故A错误;
B.1.0mol/L Na2CO3溶液,根据物料守恒可得:2c(H2CO3)+2c(HCO3-)+2c(CO32-)=c(Na+)=0.2mol/L,则:c(H2CO3)+c(HCO3-)+c(CO32-)+c(Na+)=3.0mol/L,故B正确;
C.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液,由于滴加盐酸过程中钠离子和硝酸根离子都不发生水解,则所得溶液中一定满足:c(Na+)=c(NO3-),故C正确;
D.醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液,则:c(H+)>c(OH-),根据电荷守恒可知:c(CH3COO-)>c(Na+),溶液中离子浓度大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故D正确;
故选A.
点评 本题考查了离子浓度大小比较,为高考的高频题,题目难度中等,明确盐的水解原理、电荷守恒、物料守恒的含义为解答关键,注意熟练掌握判断离子浓度大小的常用方法.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.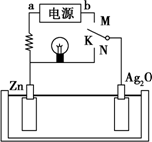 如图是某二次电池充、放电时的工作示意图,已知放电时电池反应为Zn+Ag2O+H2O═2Ag+Zn(OH)2.下列有关说法正确的是( )
如图是某二次电池充、放电时的工作示意图,已知放电时电池反应为Zn+Ag2O+H2O═2Ag+Zn(OH)2.下列有关说法正确的是( )
 如图是某二次电池充、放电时的工作示意图,已知放电时电池反应为Zn+Ag2O+H2O═2Ag+Zn(OH)2.下列有关说法正确的是( )
如图是某二次电池充、放电时的工作示意图,已知放电时电池反应为Zn+Ag2O+H2O═2Ag+Zn(OH)2.下列有关说法正确的是( )| A. | 放电时的负极反应和充电时的阴极反应属于可逆反应 | |
| B. | 在电池放电过程中溶液的pH增大 | |
| C. | K与N相接时,能量由化学能转化为电能,溶液中的OH-向正极区移动 | |
| D. | K与M连接时,所用电源的a极为负极,阳极附近溶液的pH逐渐增大 |
6.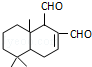 某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图(未表示出原子或原子团的空间排列).该拒食素与下列某试剂充分反应,所得有机物分子的官能团种类减少,则该试剂是( )
某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图(未表示出原子或原子团的空间排列).该拒食素与下列某试剂充分反应,所得有机物分子的官能团种类减少,则该试剂是( )
 某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图(未表示出原子或原子团的空间排列).该拒食素与下列某试剂充分反应,所得有机物分子的官能团种类减少,则该试剂是( )
某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图(未表示出原子或原子团的空间排列).该拒食素与下列某试剂充分反应,所得有机物分子的官能团种类减少,则该试剂是( )| A. | Br2的CCl4溶液 | B. | HBr | C. | Ag(NH3)2OH溶液 | D. | H2 |
10.设阿伏加德罗常数的值为NA,则下列说法正确的是( )
| A. | 1mol Na2O2中阴、阳离子的总数是4NA | |
| B. | 常温常压下,11.2 LCO2所含的原子数为1.5NA | |
| C. | 标准状况下,54g H2O中含有分子数为3NA | |
| D. | 1mol/L的MgCl2溶液中Cl-离子数为2NA |
20.在每次焰色反应实验前,都要用某试剂清洗铂丝,这种试剂是( )
| A. | 盐酸 | B. | 硫酸 | C. | 烧碱溶液 | D. | 纯碱溶液 |
7.下列有关物质应用的说法正确的是( )
| A. | 生石灰用作食品抗氧剂 | B. | 小苏打是面包发酵粉的主要成分 | ||
| C. | 铝罐可久盛食醋 | D. | 盐类都可作调味品 |
5.在相同状况下,体积不相同的三个烧瓶中分别盛满了NH3、HCl和NO2,将它们倒扣在水槽中充分溶解后,塞住瓶口取出,烧瓶内三溶液物质的量浓度之比为( )
| A. | 1:1:1 | B. | 2:2:3 | C. | 3:3:2 | D. | 无法判断 |
 如图甲、乙是电化学实验装置.请回答下列问题:
如图甲、乙是电化学实验装置.请回答下列问题: