题目内容
5.在相同状况下,体积不相同的三个烧瓶中分别盛满了NH3、HCl和NO2,将它们倒扣在水槽中充分溶解后,塞住瓶口取出,烧瓶内三溶液物质的量浓度之比为( )| A. | 1:1:1 | B. | 2:2:3 | C. | 3:3:2 | D. | 无法判断 |
分析 相同条件下,体积不同的气体,氨气和氯化氢极易溶于水,则盛有不同体积氯化氢、氨气的烧瓶分别倒立在水槽中时,水会充满整个烧瓶;二氧化氮和水反应方程式为:3NO2+H2O=2HNO3+NO,根据方程式可知,水充入烧瓶容积的$\frac{2}{3}$,根据c=$\frac{n}{V}$计算溶液的物质的量浓度.
解答 解:相同条件下,体积不相同的气体,氨气和氯化氢极易溶于水,则盛不同等体积氯化氢、氨气的烧瓶分别倒立在水槽中时,水会充满整个烧瓶;
二氧化氮和水反应方程式为:3NO2+H2O=2HNO3+NO,根据方程式知,水会充入烧瓶容积的$\frac{2}{3}$,溶液中的溶质是硝酸,其物质的量是二氧化氮的$\frac{2}{3}$,
假设烧瓶的体积为V1L、V2L、V3L,该条件下气体摩尔体积为Vm,则:n(NH3)=$\frac{{V}_{1}}{{V}_{m}}$mol,n(HCl)=$\frac{{V}_{2}}{{V}_{m}}$mol,n(NO2)=$\frac{{V}_{3}}{{V}_{m}}$mol,
三种溶液中溶质的物质的量分别为:n(NH3)=$\frac{{V}_{1}}{{V}_{m}}$mol,n(HCl)=$\frac{{V}_{2}}{{V}_{m}}$mol,n(HNO3)=$\frac{{V}_{3}}{{V}_{m}}$mol×$\frac{2}{3}$,
三种溶液的体积分别为:V(NH3)=V1L、V(HCl)=V2L,V(HNO3)=$\frac{2}{3}$V3L,
根据c=$\frac{n}{V}$计算可知,三种溶液的物质的量浓度相等,都是$\frac{1}{{V}_{m}}$mol/L,
所以所得三种溶液的物质的量浓度之比为 1:1:1,
故选A.
点评 本题考查了物质的量浓度的有关计算,题目难度中等,注意掌握物质的量浓度的概念及表达式,明确溶液中的溶质是解本题的关键,注意盛放二氧化氮的烧瓶中水的体积及溶质的物质的量,为易错点.

 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案| A. | 1.0mol/L Na2CO3溶液:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| B. | 1.0mol/L Na2CO3溶液:c(H2CO3)+c(HCO3-)+c(CO32-)+C(Na+)=3.0mol/L | |
| C. | 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-) | |
| D. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
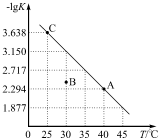 将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,在一定条件下发生下列反应:NH2COONH4(s)?2NH3(g)+CO2(g).该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示.下列说法不正确的是( )
将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,在一定条件下发生下列反应:NH2COONH4(s)?2NH3(g)+CO2(g).该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示.下列说法不正确的是( )| A. | 该反应的△H>0 | |
| B. | 30℃时,B点对应状态的v(正)<v(逆) | |
| C. | A点对应状态的平衡常数K(A)=10-2.294 | |
| D. | NH3的体积分数不变时,该反应一定达到平衡状态 |
| A. | 下列生活用品主要由有机合成材料制成:羊毛衫、腈纶运动衣、涤纶连衣裙、纯棉T恤 | |
| B. | 不锈钢制作就是在普通钢中添加铬、镍等元素改变了钢铁内部结构,所以不锈钢是化合物 | |
| C. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 | |
| D. | 建筑业使用大量的沙,常使用内陆河的河沙及海洋的海沙 |
| A. | Ag2O与CuCl反应的化学方程式为Ag2O+2CuCl═2AgCl+Cu2O | |
| B. | Ag2O溶于稀硝酸的离子方程式为Ag2O+2H+═2Ag++H2O | |
| C. | CuCl可以用铜在氯气中燃烧来制备 | |
| D. | 可以用稀硝酸来鉴别Ag2O与CuCl |
| A. | HCl(澄清石灰水) | B. | NO2(H2O) | C. | SO2(H2O2溶液) | D. | Cl2(NaOH溶液) |
 (1)已知下热化学方程式:
(1)已知下热化学方程式: