题目内容
1.在氧气中充分灼烧1.20g S和Fe组成的化合物,使其中的S全部转化为SO2,将这些SO2与Cl2反应全部转化为H2SO4,共消耗标况下氯气0.44L,则原化合物中S的质量分数为( )| A. | 53% | B. | 46% | C. | 18% | D. | 36% |
分析 根据电子转移守恒计算SO2的物质的量,再根据S原子守恒计算S的质量,进而可计算质量分数.
解答 解:根据电子转移守恒:n(SO2)=n(Cl2)=$\frac{0.44L}{22.4L/mol}$,
根据S原子守恒可知,混合物中S的质量=$\frac{0.44L}{22.4L/mol}$×32g/mol=0.63g
故混合物中S的质量分数为$\frac{0.63g}{1.20g}$×100%=53%
故选:A.
点评 本题考查混合物计算,注意利用电子转移守恒计算二氧化硫的物质的量,再结合原子守恒解答,侧重考查学生分析计算能力.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
11.如图所示装置是“乙二酸(俗名草酸)晶体受热分解”的实验,并验证分解产物中是否有CO2和CO.(图中夹持装置及尾气处理装置均已略去)
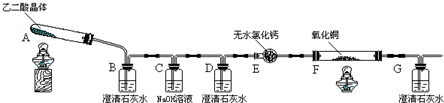
(1)装置C中盛放NaOH溶液的作用是吸收乙二酸晶体受热分解生成的二氧化碳.
(2)①证明分解产物中有CO2的现象是装置B中澄清石灰水变浑浊.
②证明分解产物中有CO的现象是装置D中澄清石灰水不变浑浊,装置F中黑色氧化铜变为红色固体,装置G中澄清石灰水变浑浊.
(3)实验结束后,装置F中黑色氧化铜变为红色固体.简述检验红色固体中是否含有Cu2O的实验方法(已知Cu2O溶于稀硫酸生成铜单质和硫酸铜):取少量红色固体,滴加稀硫酸,观察红色固体是否有部分溶解,溶液是否变蓝色.
(4)①草酸和草酸钠(Na2C2O4)可以在酸性条件下被KMnO4氧化生成CO2.KMnO4和草酸钠在稀硫酸中反应的离子方程式是:2MnO4-+16H++5C2O42-═2Mn2++10CO2↑+8H2O.
②实验室常用草酸钠标定KMnO4溶液.操作如下:准确称取0.2000g草酸钠,放入锥形瓶中,加100mL稀硫酸溶解,用配置好的KMnO4溶液滴定.当加入1滴KMnO4溶液后,锥形瓶中溶液立即由无色变为紫红色,且30s不褪色,即达到滴定终点.重复上述滴定操作三次,实验数据如下表所示.
KMnO4溶液的物质的量浓度的计算式是c(KMnO4)=$\frac{0.2000g×2mol}{5mol×134g/mol×0.01601L}$.

(1)装置C中盛放NaOH溶液的作用是吸收乙二酸晶体受热分解生成的二氧化碳.
(2)①证明分解产物中有CO2的现象是装置B中澄清石灰水变浑浊.
②证明分解产物中有CO的现象是装置D中澄清石灰水不变浑浊,装置F中黑色氧化铜变为红色固体,装置G中澄清石灰水变浑浊.
(3)实验结束后,装置F中黑色氧化铜变为红色固体.简述检验红色固体中是否含有Cu2O的实验方法(已知Cu2O溶于稀硫酸生成铜单质和硫酸铜):取少量红色固体,滴加稀硫酸,观察红色固体是否有部分溶解,溶液是否变蓝色.
(4)①草酸和草酸钠(Na2C2O4)可以在酸性条件下被KMnO4氧化生成CO2.KMnO4和草酸钠在稀硫酸中反应的离子方程式是:2MnO4-+16H++5C2O42-═2Mn2++10CO2↑+8H2O.
②实验室常用草酸钠标定KMnO4溶液.操作如下:准确称取0.2000g草酸钠,放入锥形瓶中,加100mL稀硫酸溶解,用配置好的KMnO4溶液滴定.当加入1滴KMnO4溶液后,锥形瓶中溶液立即由无色变为紫红色,且30s不褪色,即达到滴定终点.重复上述滴定操作三次,实验数据如下表所示.
| 滴定前 | 第一次终点 | 第二次终点 | 第三次终点 | |
| 滴定管 液面刻度 | 0.00mL | 16.02mL | 16.00mL | 16.01mL |
12.如图,A、B、C、D、E是长式元素周期表中的5种元素(不包括镧系和锕系).下列说法不正确的是( )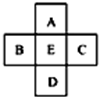

| A. | A、E原子序数之差可能为2 | B. | D、E原子序数之差可能是8、18或32 | ||
| C. | B、C原子序数之差一定是2 | D. | B、D原子序数之差不可能是7 |
13.下列关于糖类、蛋白质、油脂和维生素的说法中,正确的是( )
| A. | 它们的组成都含有C、H、O、N等元素 | |
| B. | 油脂都是高级脂肪酸的甘油酯,是一种高热量营养素 | |
| C. | 人体需要的二十多种氨基酸,都可以通过人体自身合成 | |
| D. | 在一定条件下,它们都能发生水解反应 |
 短周期元素A、B、C的位置如图所示:已知B、C两元素的原子序数之和是A元素的4倍,则C为氯(填元素名称).
短周期元素A、B、C的位置如图所示:已知B、C两元素的原子序数之和是A元素的4倍,则C为氯(填元素名称).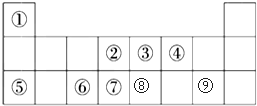
 .
.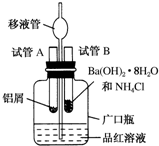 某研究性学习小组为了探究化学能与热能之间的转化,设计了以下实验装置并按如下操作进行实验:
某研究性学习小组为了探究化学能与热能之间的转化,设计了以下实验装置并按如下操作进行实验:
