题目内容
20.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )| A. | 9g甲基(-CH3)所含有的电子数是10 NA个 | |
| B. | 22.4L乙烷中含有的共价键数为7NA个 | |
| C. | 常温下,14g乙烯和丙烯的混合物中总原子数为3NA个 | |
| D. | 4.2g C3H6中含有的碳碳双键数一定为0.1NA |
分析 A、甲基不显电性;
B、乙烯所处的状态不明确;
C、乙烯和丙烯的最简式均为CH2;
D、C3H6可能为丙烯,也可能为环丙烷.
解答 解:A、9g甲基的物质的量为n=$\frac{9g}{15g/mol}$=0.6mol,而甲基不显电性,即1mol甲基中含9mol电子,则0.6mol甲基中含5.4NA个电子,故A错误;
B、乙烯所处的状态不明确,故其物质的量和含有的共价键个数无法计算,故B错误;
C、乙烯和丙烯的最简式均为CH2,故14g混合物中含有的CH2的物质的量为1mol,则含3NA个原子,故C正确;
D、C3H6可能为丙烯,也可能为环丙烷,故结构中不一定含碳碳双键,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
11.如图所示装置是“乙二酸(俗名草酸)晶体受热分解”的实验,并验证分解产物中是否有CO2和CO.(图中夹持装置及尾气处理装置均已略去)

(1)装置C中盛放NaOH溶液的作用是吸收乙二酸晶体受热分解生成的二氧化碳.
(2)①证明分解产物中有CO2的现象是装置B中澄清石灰水变浑浊.
②证明分解产物中有CO的现象是装置D中澄清石灰水不变浑浊,装置F中黑色氧化铜变为红色固体,装置G中澄清石灰水变浑浊.
(3)实验结束后,装置F中黑色氧化铜变为红色固体.简述检验红色固体中是否含有Cu2O的实验方法(已知Cu2O溶于稀硫酸生成铜单质和硫酸铜):取少量红色固体,滴加稀硫酸,观察红色固体是否有部分溶解,溶液是否变蓝色.
(4)①草酸和草酸钠(Na2C2O4)可以在酸性条件下被KMnO4氧化生成CO2.KMnO4和草酸钠在稀硫酸中反应的离子方程式是:2MnO4-+16H++5C2O42-═2Mn2++10CO2↑+8H2O.
②实验室常用草酸钠标定KMnO4溶液.操作如下:准确称取0.2000g草酸钠,放入锥形瓶中,加100mL稀硫酸溶解,用配置好的KMnO4溶液滴定.当加入1滴KMnO4溶液后,锥形瓶中溶液立即由无色变为紫红色,且30s不褪色,即达到滴定终点.重复上述滴定操作三次,实验数据如下表所示.
KMnO4溶液的物质的量浓度的计算式是c(KMnO4)=$\frac{0.2000g×2mol}{5mol×134g/mol×0.01601L}$.

(1)装置C中盛放NaOH溶液的作用是吸收乙二酸晶体受热分解生成的二氧化碳.
(2)①证明分解产物中有CO2的现象是装置B中澄清石灰水变浑浊.
②证明分解产物中有CO的现象是装置D中澄清石灰水不变浑浊,装置F中黑色氧化铜变为红色固体,装置G中澄清石灰水变浑浊.
(3)实验结束后,装置F中黑色氧化铜变为红色固体.简述检验红色固体中是否含有Cu2O的实验方法(已知Cu2O溶于稀硫酸生成铜单质和硫酸铜):取少量红色固体,滴加稀硫酸,观察红色固体是否有部分溶解,溶液是否变蓝色.
(4)①草酸和草酸钠(Na2C2O4)可以在酸性条件下被KMnO4氧化生成CO2.KMnO4和草酸钠在稀硫酸中反应的离子方程式是:2MnO4-+16H++5C2O42-═2Mn2++10CO2↑+8H2O.
②实验室常用草酸钠标定KMnO4溶液.操作如下:准确称取0.2000g草酸钠,放入锥形瓶中,加100mL稀硫酸溶解,用配置好的KMnO4溶液滴定.当加入1滴KMnO4溶液后,锥形瓶中溶液立即由无色变为紫红色,且30s不褪色,即达到滴定终点.重复上述滴定操作三次,实验数据如下表所示.
| 滴定前 | 第一次终点 | 第二次终点 | 第三次终点 | |
| 滴定管 液面刻度 | 0.00mL | 16.02mL | 16.00mL | 16.01mL |
5.次磷酸(H3PO2)是一种精细磷化工产品,属于一元弱酸,具有较强的还原性.下列有关说法正确的是( )
| A. | H3PO2溶于水的电离方程式为:H3PO2?H++H2PO2- | |
| B. | H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+3OH-═PO23-+3H2O | |
| C. | 将H3PO2溶液加入到酸性高锰酸钾溶液中,H3PO2的还原产物为H3PO4 | |
| D. | 用惰性电极电解NaH2PO2溶液,其阳极反应式为:2H2O-4e-═O2↑+4H+ |
12.如图,A、B、C、D、E是长式元素周期表中的5种元素(不包括镧系和锕系).下列说法不正确的是( )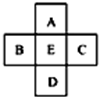

| A. | A、E原子序数之差可能为2 | B. | D、E原子序数之差可能是8、18或32 | ||
| C. | B、C原子序数之差一定是2 | D. | B、D原子序数之差不可能是7 |

 合理选择饮食,有益身体健康.小明家某次晚餐菜谱如图所示.
合理选择饮食,有益身体健康.小明家某次晚餐菜谱如图所示.




 短周期元素A、B、C的位置如图所示:已知B、C两元素的原子序数之和是A元素的4倍,则C为氯(填元素名称).
短周期元素A、B、C的位置如图所示:已知B、C两元素的原子序数之和是A元素的4倍,则C为氯(填元素名称).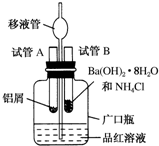 某研究性学习小组为了探究化学能与热能之间的转化,设计了以下实验装置并按如下操作进行实验:
某研究性学习小组为了探究化学能与热能之间的转化,设计了以下实验装置并按如下操作进行实验: