题目内容
下列说法或描述中,不符合实际的是( )
| A、医用药品应在低温、干燥的环境下密封保存 |
| B、反应中的某一物质的转化率α(B)增大,则该反应的平衡常数K一定增大 |
| C、向一堆篝火“鼓风”,有助于它继续燃烧下去 |
| D、微量的MnO2粉末可以使过氧化氢快速分解,而MnO2的质量在反应前后并没发生变化 |
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:A、高温可使生物制剂中的蛋白质变性而失效,也可使某些中药里的有效成分挥发,降低它们的药效;
B、平衡常数是温度的函数,某一物质的转化率增大,可能是压强和另反应物浓度的改变;
C、促进燃烧的条件可能是增大与氧气的接触面积,和增加氧气的浓度;
D、MnO2粉末在过氧化氢分解反应中起催化作用,催化剂在反应前后质量并没发生变化.
B、平衡常数是温度的函数,某一物质的转化率增大,可能是压强和另反应物浓度的改变;
C、促进燃烧的条件可能是增大与氧气的接触面积,和增加氧气的浓度;
D、MnO2粉末在过氧化氢分解反应中起催化作用,催化剂在反应前后质量并没发生变化.
解答:
解:A、高温可使生物制剂中的蛋白质变性而失效,也可使某些中药里的有效成分挥发,降低它们的药效,所以医用药品应在低温、干燥的环境下密封保存,故A正确;
B、平衡常数是温度的函数,某一物质的转化率增大,可能是压强和另反应物浓度的改变,则该反应的平衡常数不一定改变,故B错误;
C、鼓风是增加氧气的浓度,所以有助于它继续燃烧下去,故C正确;
D、MnO2粉末在过氧化氢分解反应中起催化作用,催化剂在反应前后质量并没发生变化,故D正确;
故选:B.
B、平衡常数是温度的函数,某一物质的转化率增大,可能是压强和另反应物浓度的改变,则该反应的平衡常数不一定改变,故B错误;
C、鼓风是增加氧气的浓度,所以有助于它继续燃烧下去,故C正确;
D、MnO2粉末在过氧化氢分解反应中起催化作用,催化剂在反应前后质量并没发生变化,故D正确;
故选:B.
点评:本题考查化学反应速率的影响因素,学生要掌握外界条件对反应速率的影响,解决这类题目就得心应手了.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列说法正确的是( )
①NO2气体通入FeSO4溶液中无现象;
②SiC俗称金刚砂,可用作砂纸、砂轮的磨料;
③将过量CO2气体通入水玻璃溶液中可以看到有白色胶状沉淀生成;
④用铜片在加热的条件下就可鉴别浓硫酸和稀硫酸;
⑤将盛有10mlNO2和O2的混和气体的试管倒扣于水槽中一段时间后水面可能充满整个试管;
⑥70mL的H2S和90mL的O2混合点燃后恢复到原状况可产生70mL的SO2.
①NO2气体通入FeSO4溶液中无现象;
②SiC俗称金刚砂,可用作砂纸、砂轮的磨料;
③将过量CO2气体通入水玻璃溶液中可以看到有白色胶状沉淀生成;
④用铜片在加热的条件下就可鉴别浓硫酸和稀硫酸;
⑤将盛有10mlNO2和O2的混和气体的试管倒扣于水槽中一段时间后水面可能充满整个试管;
⑥70mL的H2S和90mL的O2混合点燃后恢复到原状况可产生70mL的SO2.
| A、①③④⑤ | B、②③④⑥ |
| C、①②⑥ | D、②③④⑤ |
下列离子反应方程式,书写正确的是( )
| A、碳酸氢钠溶液中加入醋酸:CO32-+2H+=H2O+CO2↑ |
| B、稀硫酸中加入铁粉:2Fe+6H+=2Fe3++3H2↑ |
| C、碳酸钙中加入盐酸:CO32-+2H+=H2O+CO2↑ |
| D、氢氧化钠溶液中加入硫酸:H++OH-=H2O |
在一定温度下,定容密闭容器中发生反应:H2(g)+I2(g)?2HI(g),下列能说明反应已达平衡状态的是( )
| A、容器内气体压强不再变化 |
| B、混合气体的密度恒定不变 |
| C、混合气体的颜色不再变化 |
| D、v正(H2)=v逆(HI) |
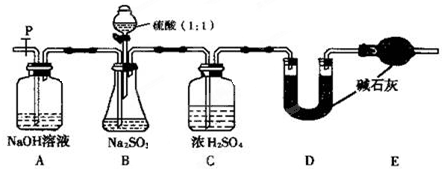
 Na2O2是中学化学常用的强氧化剂,除了能与C02、H20反应外,还可与其他还原剂如H2、C发生反应,某化学课外兴趣小组为探究Na2O2与H2的反应情况,设计了如图所示装置进行有关实验.
Na2O2是中学化学常用的强氧化剂,除了能与C02、H20反应外,还可与其他还原剂如H2、C发生反应,某化学课外兴趣小组为探究Na2O2与H2的反应情况,设计了如图所示装置进行有关实验.
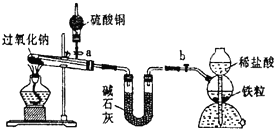
 已知:将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生.若再加入双氧水,将发生反应:H2O2+2H++2I-═2H2O+I2,且生成的I2立即与试剂X反应而被消耗.一段时间后,试剂X将被反应生成的I2完全消耗.由于溶液中的I-继续被H2O2氧化,生成的I2与淀粉作用,溶液立即变蓝.因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算反应H2O2+2H++2I-═2H2O+I2的反应速率.
已知:将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生.若再加入双氧水,将发生反应:H2O2+2H++2I-═2H2O+I2,且生成的I2立即与试剂X反应而被消耗.一段时间后,试剂X将被反应生成的I2完全消耗.由于溶液中的I-继续被H2O2氧化,生成的I2与淀粉作用,溶液立即变蓝.因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算反应H2O2+2H++2I-═2H2O+I2的反应速率.