题目内容
能正确表示下列反应的离子方程式为( )
| A、大理石溶于盐酸中:CO32-+2H+=CO2↑+H2O |
| B、氯化铝加到过量氢氧化钠溶液中:Al3++4OH-=[Al(OH)4]- |
| C、(NH4)2CO3溶液中加入过量Ba(OH)2溶液:NH4++OH-=NH3↑+H2O |
| D、氯化铁溶液中加入铜片:Fe3++Cu=Fe2++Cu2+ |
考点:离子方程式的书写
专题:
分析:A.碳酸钙为沉淀应保留化学式;
B.氯化铝加到过量氢氧化钠溶液中,反应生成四羟基合铝酸钠;
C.漏掉了碳酸根离子与钡离子的反应;
D.电荷不守恒.
B.氯化铝加到过量氢氧化钠溶液中,反应生成四羟基合铝酸钠;
C.漏掉了碳酸根离子与钡离子的反应;
D.电荷不守恒.
解答:
解:A.大理石溶于盐酸中,离子方程式:CaCO3+2H+=CO2↑+H2O+Ca2+,故A错误;
B.氯化铝加到过量氢氧化钠溶液中,离子方程式:Al3++4OH-=[Al(OH)4]-,故B正确;
C.(NH4)2CO3溶液中加入过量Ba(OH)2溶液,离子方程式:CO32-+Ba2++2NH4++2OH-=2NH3↑+2H2O+BaCO3↓,故C错误;
D.氯化铁溶液中加入铜片,离子方程式:2Fe3++Cu=2Fe2++Cu2+,故D错误;
故选:B.
B.氯化铝加到过量氢氧化钠溶液中,离子方程式:Al3++4OH-=[Al(OH)4]-,故B正确;
C.(NH4)2CO3溶液中加入过量Ba(OH)2溶液,离子方程式:CO32-+Ba2++2NH4++2OH-=2NH3↑+2H2O+BaCO3↓,故C错误;
D.氯化铁溶液中加入铜片,离子方程式:2Fe3++Cu=2Fe2++Cu2+,故D错误;
故选:B.
点评:本题考查了离子方程式的书写,为高考的热门考点,明确反应的实质是解题关键,注意离子方程式应符合客观事实,遵循原子个数守恒,遵循电荷守恒,选项C为易错选项.

练习册系列答案
相关题目
下列物质互为同分异构体的一组是( )
| A、35Cl和37Cl |
| B、CH3CH2OH和CH3OCH3 |
| C、O2和O3 |
| D、甲苯和邻二甲苯 |
下列说法中不正确的是( )
| A、在非标准状况下,1 mol O2的体积也有可能是22.4 L |
| B、在温度和压强一定时,气态物质的体积主要由气体分子数目和分子的大小决定 |
| C、同温同压下,0.3 mol N2和0.7 mol O2的体积比为3:7 |
| D、同温同压下,相同体积的任何气体所含有的分子数目一定相同 |
设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A、1mol乙基(-C2H5)中含有的电子数为17NA |
| B、标准状况下,22.4L氯仿(三氯甲烷)中共价键数目为4NA |
| C、1L pH=1的稀硫酸中有0.2 NA个H+ |
| D、78gNa2O2中含有2NA个阴离子(相对原子质量:Na-23 O-16) |
下列离子反应方程式,书写正确的是( )
| A、碳酸氢钠溶液中加入醋酸:CO32-+2H+=H2O+CO2↑ |
| B、稀硫酸中加入铁粉:2Fe+6H+=2Fe3++3H2↑ |
| C、碳酸钙中加入盐酸:CO32-+2H+=H2O+CO2↑ |
| D、氢氧化钠溶液中加入硫酸:H++OH-=H2O |
 某学生利用C、N、0三种原子拼接成了一种新型分子TetranitiBtoxycarbon(结构如图所示),科学家经过研究发现,这种分子具有良好的贮能特性,一旦被合成完全可用于制造新的炸药.下列有关说法正确的是( )
某学生利用C、N、0三种原子拼接成了一种新型分子TetranitiBtoxycarbon(结构如图所示),科学家经过研究发现,这种分子具有良好的贮能特性,一旦被合成完全可用于制造新的炸药.下列有关说法正确的是( )| A、该分子的分子式为CNO3 |
| B、分子中既含极性键又含非极性键 |
| C、C、N的化合价分别为+4、+3 |
| D、C、N、0的第一电离能依次增大 |
要使溶液中存在大量的K+、Na+、H+、NO3-和SO42-五种离子,则在蒸馏水中至少溶解几种物质( )
| A、2种 | B、3种 | C、4种 | D、5种 |
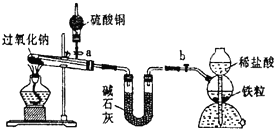 Na2O2是中学化学常用的强氧化剂,除了能与C02、H20反应外,还可与其他还原剂如H2、C发生反应,某化学课外兴趣小组为探究Na2O2与H2的反应情况,设计了如图所示装置进行有关实验.
Na2O2是中学化学常用的强氧化剂,除了能与C02、H20反应外,还可与其他还原剂如H2、C发生反应,某化学课外兴趣小组为探究Na2O2与H2的反应情况,设计了如图所示装置进行有关实验.