题目内容
12.如表是元素周期表的一部分.根据①~⑫元素在周期表中的位置,回答下列有关问题:(请用化学符号填写)
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)在这些元素的最高价氧化物对应水化物中,酸性最强的是HClO4,呈两性的氢氧化物是Al(OH)3.(用化学式填写)
(3)在这些元素中单质的氧化性最强的是F2,还原性最强的是K.化学性质最不活泼的元素是Ar.(用化学式填写)
(4)用电子式表示⑦和⑩形成化合物的过程:
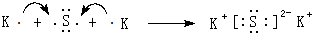 .
.(5)⑦和⑧分别形成的气态氢化物中相对不稳定的是H2S.
分析 (1)由元素在周期表中位置,可知①为N、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦为S、⑧为Cl、⑨为Ar、⑩为K、⑪为Ca、⑫为Br;
(2)最高价氧化物对应水化物中酸性最强的是高氯酸,氢氧化铝属于两性氢氧化物;
(3)同周期自左而右非金属性增强、金属性减弱,同主族自上而下非金属性减弱,金属性最强,非金属性越强,单质氧化性越强,金属性越强,单质还原性越强;稀有气体原子最外层为稳定结构,化学性质最不活泼;
(4)⑦和⑩形成化合物为K2S,由钾离子与硫离子构成;
(5)非金属性越强,对应氢化物越稳定.
解答 解:(1)由元素在周期表中位置,可知①为N、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦为S、⑧为Cl、⑨为Ar、⑩为K、⑪为Ca、⑫为Br,
故答案为:N;Si;
(2)最高价氧化物对应水化物中酸性最强的是HClO4,Al(OH)3 属于两性氢氧化物,
故答案为:HClO4;Al(OH)3;
(3)同周期自左而右非金属性增强、金属性减弱,同主族自上而下非金属性减弱,金属性最强,非金属性越强,单质氧化性越强,金属性越强,单质还原性越强,单质的氧化性最强的是F2,还原性最强的是K,稀有气体原子最外层为稳定结构,Ar的化学性质最不活泼,
故答案为:F2;K;Ar;
(4)⑦和⑩形成化合物为K2S,由钾离子与硫离子构成,用电子式表示形成过程为: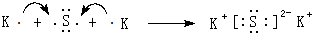 ,
,
故答案为: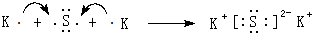 ;
;
(5)⑦和⑧分别形成的气态氢化物的化学式是分别为H2S、HCl,非金属性Cl>S,非金属性越强,对应氢化物越稳定,故氢化物稳定性:H2S<HCl,
故答案为:H2S.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、性质、元素化合物知识及元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

| A. | CH4O | B. | C3H8O | C. | C3H6 | D. | C2H4O2 |
| A. | 夜晚霓虹灯放出五颜六色的光 | B. | 漂白粉消毒 | ||
| C. | 明矾净水 | D. | 二氧化硫熏蒸银耳 |

| A. | 锌锰电池的负极是锌,发生的反应是Zn-2e-═Zn2+ | |
| B. | 普通锌锰电池在使用过程中锌外壳逐渐变薄,最后内部糊状的电解质会泄漏出来 | |
| C. | 碱性锌锰电池的使用寿命和性能都优于普通锌锰电池 | |
| D. | 锌锰电池是二次电池 |
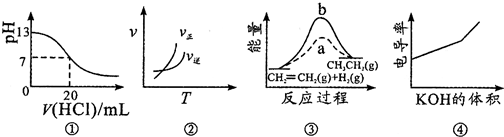
| A. | 图①表示25℃时,用0.1mol•L-1盐酸滴定20mL0.1mol•L-1NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 图②中曲线表示反应A2(g)+3B2(g)?2AB3(g)△H<0 | |
| C. | 图③中a、b曲线分别表示反应CH2═CH2(g)+H2(g)═CH3CH3(g)△H<0,使用和未使用催化剂时反应过程中的能量变化 | |
| D. | 电导率是衡量电解质溶液导电能力大小的物理量,图④表示KOH溶液滴定CH3COOH溶液时溶液的电导率变化曲线示意图 |
| A. | SiH4比CH4稳定 | |
| B. | O2-半径比F-的大 | |
| C. | Na和Cs属于第 IA族元素,Cs失电子能力比Na弱 | |
| D. | P和As属于第 VA族元素,H3PO4酸性比H3AsO4弱 |
| A | B | ||||||
| D | E | F | |||||
| C | G | H |
(2)比较D、G氢化物的稳定性CH4>SiH4(用化学式表示).
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为:
 ;
;(4)D、E、G、H四种元素最高价含氧酸的酸性由强到弱的顺序是:HClO4>HNO3>H2CO3>H2SiO3(填化学式).
(5)A、D两种元素构成的两种烃X和Y,X是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平;Y是一种比水轻的油状液体,两种元素的质量比为12:1,Y的相对分子质量为78.
①X的结构简式CH2=CH2.
②Y与浓硫酸与浓硝酸在50~60℃反应的化学反应方程式:
 +HNO3$→_{50~60℃}^{浓硫酸}$
+HNO3$→_{50~60℃}^{浓硫酸}$ +H2O,反应类型取代反应.
+H2O,反应类型取代反应. 
 2SO3.
2SO3.