题目内容
1.A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).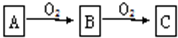
(1)若A是一种黄色单质固体,则B→C的化学方程式为2SO2+O2
 2SO3.
2SO3.(2)若C是红棕色气体,A可能是一种能使湿润的红色石蕊试纸变蓝的气体.回答下列问题:
①写出实验室制取A的化学方程式:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
若有5.35g氯化铵参加反应,则产生的A气体在标准状况下的体积为2.24 L.
②C与水反应可得到酸X.写出足量X的浓溶液与Cu反应的离子方程式:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O.
分析 (1)若A是一种黄色单质固体,则A为S,与氧气反应生成B为SO2,进一步与氧气反应生成C为SO3;
(2)若C是红棕色气体,A可能是一种能使湿润的红色石蕊试纸变蓝的气体,则A为NH3,B为NO,C为NO2.
解答 解:(1)若A是一种黄色单质固体,则A是S单质,属于B是二氧化硫,C是三氧化硫,则B→C的化学方程式为2SO2+O2 2SO3,
2SO3,
故答案为:2SO2+O2 2SO3;
2SO3;
(2)若C是红棕色气体,A可能是一种能使湿润的红色石蕊试纸变蓝的气体,则A为NH3,B为NO,C为NO2,
①实验室用氢氧化钙和氯化铵在加热条件下制备氨气,反应的方程式为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,n(NH3)=n(NH4Cl)=$\frac{5.35g}{53.5g/mol}$=0.1mol,则V(NH3)=0.1mol×22.4L/mol=2.24L,
故答案为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;2.24;
②C为NO2,与水反应反应的方程式为3NO2+H2O=2HNO3+NO,生成的酸X为HNO3,硝酸具有强氧化性,浓硝酸与铜反应反应的离子方程式为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,
故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O.
点评 本题考查无机物的推断,是高考中的常见题型,属于基础性试题的考查,试题难易适中,侧重对学生基础知识的巩固训练,物质特殊的颜色、性质是推断的突破口,熟练掌握中学常见连续反应.

练习册系列答案
相关题目
11.下列说法正确的是(NA为阿伏伽德罗常数)( )
| A. | 12g石墨中含有C-C键的个数为1.5NA | |
| B. | 60g SiO2中含有Si-O键的个数为2NA | |
| C. | 18g冰中最多含有4 NA个氢键 | |
| D. | 标准状况下,11.2 L CHCl3中含有的分子数为0.5NA |
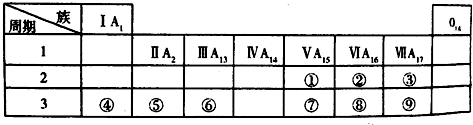
12.如表是元素周期表的一部分.
根据①~⑫元素在周期表中的位置,回答下列有关问题:(请用化学符号填写)
(1)写出下列元素符号:①N,⑥Si.
(2)在这些元素的最高价氧化物对应水化物中,酸性最强的是HClO4,呈两性的氢氧化物是Al(OH)3.(用化学式填写)
(3)在这些元素中单质的氧化性最强的是F2,还原性最强的是K.化学性质最不活泼的元素是Ar.(用化学式填写)
(4)用电子式表示⑦和⑩形成化合物的过程: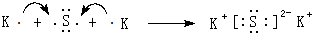 .
.
(5)⑦和⑧分别形成的气态氢化物中相对不稳定的是H2S.
根据①~⑫元素在周期表中的位置,回答下列有关问题:(请用化学符号填写)
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)在这些元素的最高价氧化物对应水化物中,酸性最强的是HClO4,呈两性的氢氧化物是Al(OH)3.(用化学式填写)
(3)在这些元素中单质的氧化性最强的是F2,还原性最强的是K.化学性质最不活泼的元素是Ar.(用化学式填写)
(4)用电子式表示⑦和⑩形成化合物的过程:
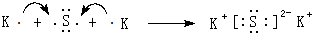 .
.(5)⑦和⑧分别形成的气态氢化物中相对不稳定的是H2S.
9.欲制取较纯净的CH2ClCH2Cl,可采取的方法是( )
| A. | 乙烷与Cl2取代 | B. | 乙烯与Cl2加成 | ||
| C. | 乙醇与浓盐酸取代 | D. | 乙炔与HCl加成 |
13.若甲烷与氯气以物质的量之比1:1混合,在光照下得到的有机取代产物是( )
①CH3Cl、②CH2C12、③CHCl3、④CCl4.
①CH3Cl、②CH2C12、③CHCl3、④CCl4.
| A. | 只有① | B. | 只有③ | C. | ①②③的混合物 | D. | ①②③④的混合物 |
10.体积为VmL,密度为ρg/cm3的溶液,含有相对分子质量为M的溶质mg,其物质的量浓度为cmol/L,质量分数为w%,下列表示不正确的是( )
| A. | c=$\frac{w•1000•ρ}{M}$ | B. | m=$\frac{Vρw}{100}$ | C. | c=$\frac{1000m}{(V•M)}$ | D. | w=$\frac{cM}{1000ρ}$ |
 NH3:3H•+
NH3:3H•+ →
→ .
.