题目内容
20.下列说法正确的有几个:①反应4A(s)+3B(g)?2C(g)+D(g),经2min,B的浓度减少0.6mol/L,则用A表示的反应速率为0.4mol•L-1•min-1 ②升高温度一定能增大化学反应速率,但不改变活化分子的百分数③在固定体积的密闭容器中进行反应:2HI(g)?H2(g)+I2(g),当反应体系的颜色不再变化,说明反应已达平衡④升高温度,化学平衡常数增大,说明该反应的正反应为放热反应⑤△H>0,△S<0的反应在所有温度下都不能自发进行( )| A. | 1个 | B. | 2 | C. | 3 | D. | 4 |
分析 ①固体在反应过程中没有浓度变化;
②升高温度改变活化分子百分数,反应速率一定改变;
③在固定体积的密闭容器中进行反应:2HI(g)?H2(g)+I2(g),当反应体系的颜色不再变化,说明碘的浓度不变;
④升高温度,化学平衡常数增大,说明平衡正向移动,升高温度平衡向吸热方向移动;
⑤当△H-T△S<0,反应自发进行.
解答 解:①固体在反应过程中没有浓度变化,A是固体,在反应前后固体成分不变,所以不能用A表示反应速率,故①错误;
②升高温度使部分非活化分子转化为活化分子,所以活化分子百分数增大,反应速率一定增大,故②错误;
③在固定体积的密闭容器中进行反应:2HI(g)?H2(g)+I2(g),当反应体系的颜色不再变化,说明碘的浓度不变,正逆反应速率相等,则该反应达到平衡状态,故③正确;
④升高温度,化学平衡常数增大,说明平衡正向移动,升高温度平衡向吸热方向移动,说明正反应是吸热反应,故④错误;
⑤当△H-T△S<0,反应自发进行,△H>0,△S<0,△H-T△S>0,所有温度下反应不能自发进行,故⑤正确;
故选B.
点评 本题考查较综合,涉及平衡状态判断、反应热的判断、反应自发性判断、化学反应速率影响因素等知识点,明确化学反应原理及其影响因素是解本题关键,知道反应自发性及化学平衡状态判断方法,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.28%的KOH溶液中,平均溶有一个OH-所需的水分子的个数为( )
| A. | 6个 | B. | 8个 | C. | 10个 | D. | 28个 |
11.下列说法正确的是(NA为阿伏伽德罗常数)( )
| A. | 12g石墨中含有C-C键的个数为1.5NA | |
| B. | 60g SiO2中含有Si-O键的个数为2NA | |
| C. | 18g冰中最多含有4 NA个氢键 | |
| D. | 标准状况下,11.2 L CHCl3中含有的分子数为0.5NA |
8.世界上一次性建成的最长高速铁路--京沪高铁,列车时速高达380公里,车厢大部分采用铝合金材料制造,这是因为铝合金( )
| A. | 比纯铝熔点高 | |
| B. | 各种成分在自然界中含量丰富,容易获取 | |
| C. | 具有比较活泼的化学性质 | |
| D. | 质量轻,强度大,抗腐蚀能力比较强 |
15.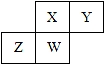 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法正确的是( )
 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Z>W>X | |
| C. | 最简单气态氢化物的热稳定性:Y>X>W>Z | |
| D. | 元素Y、Z形成的化合物是制造光电池的主要材料 |
5.下列反应中不是氧化还原反应的是( )
| A. | 3Cl2+6KOH═5KCl+KClO3+3H2O | B. | CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O | ||
| C. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | D. | 2AgNO3+BaCl2═2AgCl↓+Ba(NO3)2 |
12.如表是元素周期表的一部分.
根据①~⑫元素在周期表中的位置,回答下列有关问题:(请用化学符号填写)
(1)写出下列元素符号:①N,⑥Si.
(2)在这些元素的最高价氧化物对应水化物中,酸性最强的是HClO4,呈两性的氢氧化物是Al(OH)3.(用化学式填写)
(3)在这些元素中单质的氧化性最强的是F2,还原性最强的是K.化学性质最不活泼的元素是Ar.(用化学式填写)
(4)用电子式表示⑦和⑩形成化合物的过程: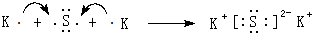 .
.
(5)⑦和⑧分别形成的气态氢化物中相对不稳定的是H2S.
根据①~⑫元素在周期表中的位置,回答下列有关问题:(请用化学符号填写)
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)在这些元素的最高价氧化物对应水化物中,酸性最强的是HClO4,呈两性的氢氧化物是Al(OH)3.(用化学式填写)
(3)在这些元素中单质的氧化性最强的是F2,还原性最强的是K.化学性质最不活泼的元素是Ar.(用化学式填写)
(4)用电子式表示⑦和⑩形成化合物的过程:
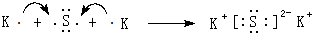 .
.(5)⑦和⑧分别形成的气态氢化物中相对不稳定的是H2S.
9.欲制取较纯净的CH2ClCH2Cl,可采取的方法是( )
| A. | 乙烷与Cl2取代 | B. | 乙烯与Cl2加成 | ||
| C. | 乙醇与浓盐酸取代 | D. | 乙炔与HCl加成 |
10.体积为VmL,密度为ρg/cm3的溶液,含有相对分子质量为M的溶质mg,其物质的量浓度为cmol/L,质量分数为w%,下列表示不正确的是( )
| A. | c=$\frac{w•1000•ρ}{M}$ | B. | m=$\frac{Vρw}{100}$ | C. | c=$\frac{1000m}{(V•M)}$ | D. | w=$\frac{cM}{1000ρ}$ |