题目内容
2.如表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素.| A | B | ||||||
| D | E | F | |||||
| C | G | H |
(2)比较D、G氢化物的稳定性CH4>SiH4(用化学式表示).
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为:
 ;
;(4)D、E、G、H四种元素最高价含氧酸的酸性由强到弱的顺序是:HClO4>HNO3>H2CO3>H2SiO3(填化学式).
(5)A、D两种元素构成的两种烃X和Y,X是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平;Y是一种比水轻的油状液体,两种元素的质量比为12:1,Y的相对分子质量为78.
①X的结构简式CH2=CH2.
②Y与浓硫酸与浓硝酸在50~60℃反应的化学反应方程式:
 +HNO3$→_{50~60℃}^{浓硫酸}$
+HNO3$→_{50~60℃}^{浓硫酸}$ +H2O,反应类型取代反应.
+H2O,反应类型取代反应.
分析 由元素在短周期中的位置,可知A为氢,B为He,C为Na,D为碳,E为氮,F为氧,G为Al,H为Cl.
(1)VIA族中元素形成的单质中有原子晶体,单质的沸点可能最高,而原子晶体中原子半径越小,其沸点越高;
(2)非金属性越强,元素对应的氢化物越稳定;
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物为NH3;
(4)元素的非金属性越强,最高价含氧酸的酸性最强,高氯酸是最强的无机含氧酸;
(5)A、D两种元素构成的两种烃X和Y,X是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平,则X为乙烯,Y是一种比水轻的油状液体,两种元素的质量比为12:1,分子中C、H原子数目之比为$\frac{12}{12}$:$\frac{1}{1}$=1:1,Y的相对分子质量为78,则Y为 .
.
解答 解:由元素在短周期中的位置,可知A为氢,B为He,C为Na,D为碳,E为氮,F为氧,G为Al,H为Cl.
(1)Si单质、碳的单质都可以形成原子晶体,单质的沸点可能高于其它主族,但C-C键键长比Si-Si键键长短,C-C键更强,故碳单质的熔点可能最高,
故答案为:碳;
(2)C、Si同主族,自上而下非金属性减弱,氢化物的稳定性减弱,故氢化物稳定性CH4>SiH4,故答案为:CH4>SiH4;
(3)A与E形成的一种极易溶于水的气态化合物为NH3,分子中N原子与H原子之间形成1对共用电子对,电子式为 ,
,
故答案为: ;
;
(4)高氯酸是最强的无机含氧酸,非金属性N>C>Si,元素的非金属性越强,最高价含氧酸的酸性最强,故酸性:HClO4>HNO3>H2CO3>H2SiO3,
故答案为:HClO4>HNO3>H2CO3>H2SiO3;
(5)A、D两种元素构成的两种烃X和Y,X是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平,则X为乙烯,Y是一种比水轻的油状液体,两种元素的质量比为12:1,分子中C、H原子数目之比为$\frac{12}{12}$:$\frac{1}{1}$=1:1,Y的相对分子质量为78,则Y为 .
.
①X为乙烯,结构简式为:CH2=CH2,故答案为:CH2=CH2;
②Y为苯,与浓硫酸与浓硝酸在50~60℃反应的化学反应方程式: +HNO3$→_{50~60℃}^{浓硫酸}$
+HNO3$→_{50~60℃}^{浓硫酸}$ +H2O,属于取代反应,
+H2O,属于取代反应,
故答案为: +HNO3$→_{50~60℃}^{浓硫酸}$
+HNO3$→_{50~60℃}^{浓硫酸}$ +H2O,取代反应.
+H2O,取代反应.
点评 本题考查元素周期表与元素周期律的综合应用、电子式、有机物化学基础等,难度不大,注意熟练掌握元素周期律表的结构.

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案根据①~⑫元素在周期表中的位置,回答下列有关问题:(请用化学符号填写)
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)在这些元素的最高价氧化物对应水化物中,酸性最强的是HClO4,呈两性的氢氧化物是Al(OH)3.(用化学式填写)
(3)在这些元素中单质的氧化性最强的是F2,还原性最强的是K.化学性质最不活泼的元素是Ar.(用化学式填写)
(4)用电子式表示⑦和⑩形成化合物的过程:
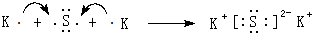 .
.(5)⑦和⑧分别形成的气态氢化物中相对不稳定的是H2S.
①CH3Cl、②CH2C12、③CHCl3、④CCl4.
| A. | 只有① | B. | 只有③ | C. | ①②③的混合物 | D. | ①②③④的混合物 |
| A. | c=$\frac{w•1000•ρ}{M}$ | B. | m=$\frac{Vρw}{100}$ | C. | c=$\frac{1000m}{(V•M)}$ | D. | w=$\frac{cM}{1000ρ}$ |
| A. | NaOH | B. | MgCl2 | C. | H2O | D. | HCl |
| A. | 3.2g由O2和O3组成的混合物中含有氧原子的数目为0.2NA | |
| B. | 0.1mol苯中含有碳碳双键的数目为0.3NA | |
| C. | 标准状况下,11.2L三氯甲烷中含有分子的数目为0.5NA | |
| D. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA |
 ,则合成涤纶的反应方程式和反应类型分别是
,则合成涤纶的反应方程式和反应类型分别是 、缩聚反应.
、缩聚反应. NH3:3H•+
NH3:3H•+ →
→ .
. 和
和
 和
和 ⑦CH2=CH-CH2CH3和 CH3-CH=CH-CH3.
⑦CH2=CH-CH2CH3和 CH3-CH=CH-CH3.