题目内容
3.下列所述变化规律正确的是( )| A. | Na、Mg、Al还原性依次增强 | |
| B. | HCl、H2S、PH3稳定性依次减弱 | |
| C. | NaOH、KOH、Mg(OH)2碱性依次增强 | |
| D. | S2-、Cl-、K+、Ca2+离子半径依次增大 |
分析 A.元素的金属性越强,对应的单质的还原性越强;
B.元素的非金属性越强,对应的氢化物越稳定;
C.元素的金属性越强,对应的最高价氧化物的水化物的碱性越强;
D.核外电子排布相同的离子,核电荷数越大,离子半径越小.
解答 解:A.金属性Na>Mg>Al,元素的金属性越强,对应的单质的还原性越强,故A错误;
B.非金属性Cl>S>P,元素的非金属性越强,对应的氢化物越稳定,故B错误;
C.金属性Na<K<Cs,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,故C正确;
D.S2-、Cl-、K+、Ca2+核外电子排布相同,核电荷数越大,离子半径越小,故D错误.
故选C.
点评 本题多角度考查元素周期表与周期律知识,为高考常见题型和高频考点,侧重于基础知识的综合理解与运用的考查,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
15.利用某些有机物之间的相互转换可以贮存太阳能,如原降冰片二烯(NBD)经过太阳光照转化成为四环烷(Q).
已知:①C7H8(l)(NBD)+9O2(g)═7CO2(g)+4H2O(g);△H1;
②C7H8(l)(Q)+9O2(g)═7CO2(g)+4H2O(l);△H2;
③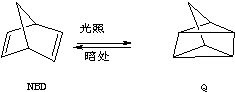 ;△H=+88.62kJ•mol-1
;△H=+88.62kJ•mol-1
下列叙述不正确的是( )
已知:①C7H8(l)(NBD)+9O2(g)═7CO2(g)+4H2O(g);△H1;
②C7H8(l)(Q)+9O2(g)═7CO2(g)+4H2O(l);△H2;
③
 ;△H=+88.62kJ•mol-1
;△H=+88.62kJ•mol-1下列叙述不正确的是( )
| A. | △H1>△H2 | B. | 等质量NBD的能量比Q的能量高 | ||
| C. | NBD比Q稳定 | D. | NBD转化为Q是吸热反应 |
11.下列说法正确的是( )
| A. | 沸点:乙烷>甲烷 | |
| B. | 二氯甲烷有两种不同结构的同分异构体 | |
| C. | C2H4与C4H8一定是同系物 | |
| D. | 甲苯的一氯代物有三种 |
8.下列物质的熔、沸点高低顺序正确的是( )
| A. | 金刚石>晶体硅>碳化硅 | B. | 氧化铝>氯化钾>氯化钠 | ||
| C. | CBr4>CCl4>CF4 | D. | AsH3>PH3>NH3 |
15.二氧化硫是硫的重要化合物,在生产、生活中有广泛应用.二氧化硫有毒,并且是形成酸雨的主要气体.无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要.完成下列填空:
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫.
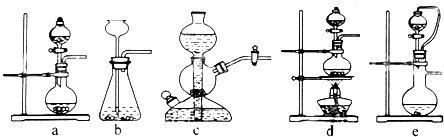
如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置是ae(填写字母).
(2)若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,至少需要称取亚硫酸钠18.9g(保留一位小数);如果已有40%亚硫酸钠(质量分数),被氧化成硫酸钠,则至少需称取该亚硫酸钠33.1g (保留一位小数).
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通.石灰-石膏法和碱法是常用的烟气脱硫法.
石灰-石膏法的吸收反应为SO2+Ca(OH)2→CaSO3↓+H2O.吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O→2CaSO4•2H2O.其流程如图1,碱法的吸收反应为SO2+2NaOH→Na2SO3+H2O.碱法的特点是氢氧化钠碱性强、吸收快、效率高.其流程如图2:
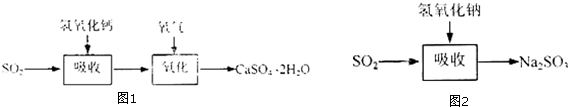
已知:
石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是利用SO2是酸性氧化物,可与碱反应.和碱法相比,石灰-石膏法的优点是原料易得,成本低,缺点是亚硫酸钙在输送中容易造成管道堵塞,吸收速率慢,效率低.
(4)在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示).
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫.

如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置是ae(填写字母).
(2)若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,至少需要称取亚硫酸钠18.9g(保留一位小数);如果已有40%亚硫酸钠(质量分数),被氧化成硫酸钠,则至少需称取该亚硫酸钠33.1g (保留一位小数).
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通.石灰-石膏法和碱法是常用的烟气脱硫法.
石灰-石膏法的吸收反应为SO2+Ca(OH)2→CaSO3↓+H2O.吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O→2CaSO4•2H2O.其流程如图1,碱法的吸收反应为SO2+2NaOH→Na2SO3+H2O.碱法的特点是氢氧化钠碱性强、吸收快、效率高.其流程如图2:
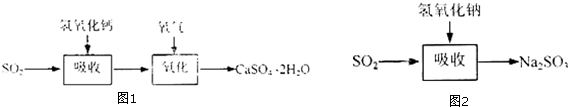
已知:
| 试剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
(4)在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示).
12.坏血病患者应该多吃( )
| A. | 水果和蔬菜 | B. | 鱼肉和猪肉 | C. | 鸡蛋和鸭蛋 | D. | 早米和肝脏 |
 ,结构式是F-O-O-O-F.
,结构式是F-O-O-O-F.