题目内容
14.工业上利用硅的氧化物制取硅单质,主要反应为:SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.该反应中,还原剂是C(填化学式),被还原的物质是SiO2(填化学式);若反应中消耗了1.5mol C,则生成0.75mol Si,转移电子的物质的量为3mol.分析 反应SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO中,Si元素化合价降低,被还原,SiO2为氧化剂,C元素化合价升高,被氧化,C为还原剂,结合反应的化学方程式解答该题.
解答 解:反应SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO中Si元素化合价降低,被还原,SiO2为氧化剂,C元素化合价升高,被氧化,C为还原剂,由方程式可知,若反应中消耗了1.5mol C,则生成0.75mol Si,转移电子的物质的量为(2-0)×1.5mol=3mol.
故答案为:C;SiO2;0.75;3.
点评 本题考查氧化还原反应,侧重于化学与工业生产的考查,有利于培养学生的良好的科学素养,提高学习的积极性,注意从元素化合价的角度解答该题,难度不大.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
6.反应2NO(g)+2H2(g)═N2(g)+2H2O(g)中,每生成7gN2放出166kJ的热量,该反应的速率表达式为v=k•cm(NO)•cn(H2)(k、m、n待测),其反应包含下下列两步:
①2NO+H2═N2+H2O2(慢)
②H2O2+H2═2H2O(快)
T℃时测得有关实验数据如下:
下列说法错误的是( )
①2NO+H2═N2+H2O2(慢)
②H2O2+H2═2H2O(快)
T℃时测得有关实验数据如下:
| 序号 | c(NO)/mol•L-1 | c(H2)/mol•L-1 | 速率/mol•L-1•min-1 |
| Ⅰ | 0.0060 | 0.0010 | 1.8×10-4 |
| Ⅱ | 0.0060 | 0.0020 | 3.6×10-4 |
| Ⅲ | 0.0010 | 0.0060 | 3.0×10-5 |
| Ⅳ | 0.0020 | 0.0060 | 1.2×10-4 |
| A. | 整个反应速度由第①步反应决定 | |
| B. | 正反应的活化能一定是①<② | |
| C. | 该反应速率表达式:v=5000c2(NO)•c(H2) | |
| D. | 该反应的热化学方程式为2NO(g)+2H2(g)═N2(g)+2H2O(g)△H=-664kJ•mol-1 |
9.氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质.下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是( )
| A. | 使新鲜的红玫瑰花褪色(HCl) | B. | 新制氯水呈浅黄绿色(Cl2) | ||
| C. | 加入小苏打固体,有气泡产生(H+) | D. | 滴加AgNO3溶液生成白色沉淀(Cl-) |
3.下列所述变化规律正确的是( )
| A. | Na、Mg、Al还原性依次增强 | |
| B. | HCl、H2S、PH3稳定性依次减弱 | |
| C. | NaOH、KOH、Mg(OH)2碱性依次增强 | |
| D. | S2-、Cl-、K+、Ca2+离子半径依次增大 |
4.抗生素药物“芬必得”的主要成分的结构简式如图所示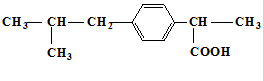 ,下列关于“芬必得”主要成分的叙述中不正确的是( )
,下列关于“芬必得”主要成分的叙述中不正确的是( )
 ,下列关于“芬必得”主要成分的叙述中不正确的是( )
,下列关于“芬必得”主要成分的叙述中不正确的是( )| A. | 该物质的分子式为C13H18O2 | B. | 该物质属于芳香烃 | ||
| C. | 该物质属于羧酸类有机物 | D. | 该物质可以发生取代反应 |
 (1)已知拆开1mol H-H键、1mol I-I、1mol H-I键分别需要吸收的能量为436kJ、151kJ、295kJ,则由氢气和碘反应生成1mol HI的反应热 为-1.5kJ/mol
(1)已知拆开1mol H-H键、1mol I-I、1mol H-I键分别需要吸收的能量为436kJ、151kJ、295kJ,则由氢气和碘反应生成1mol HI的反应热 为-1.5kJ/mol