题目内容
8.下列物质的熔、沸点高低顺序正确的是( )| A. | 金刚石>晶体硅>碳化硅 | B. | 氧化铝>氯化钾>氯化钠 | ||
| C. | CBr4>CCl4>CF4 | D. | AsH3>PH3>NH3 |
分析 A.原子晶体中,熔沸点高低与键长成反比;
B.离子晶体中,熔沸点与电荷成正比、与离子半径成反比;
C.分子晶体中,熔沸点与相对分子质量成正比;
D.NH3分子间可形成氢键,AsH3和PH3比较相对分子质量.
解答 解:A.原子晶体中,熔沸点高低与键长成反比,这几种物质都是原子晶体,键长C-C<C-Si<Si-Si,所以熔沸点金刚石>碳化硅>晶体硅,故A错误;
B.离子晶体中,熔沸点与电荷成正比、与离子半径成反比,铝离子带3个单位电荷、氧离子带2个单位电荷,钠离子、钾离子和氯离子都带一个单位电荷,且钾离子半径大于钠离子,所以熔沸点Al2O3>NaCl>KCl,故B错误;
C.分子晶体中,熔沸点与相对分子质量成正比,相对分子质量CBr4>CCl4>CF4,所以熔沸点CBr4>CCl4>CF4,故C正确;
D.NH3分子间可形成氢键,沸点最大,AsH3的相对分子质量大于PH3,因此沸点NH3>AsH3>PH3,故D错误;
故选C.
点评 本题考查离子晶体、原子晶体、金属晶体、分子晶体熔沸点高低判断,侧重考查知识运用,明确晶体类型及晶体熔沸点高低影响因素即可解答,题目难度不大.

练习册系列答案
相关题目
20.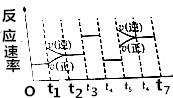 反应3A(g)?2B(g)+C(g)+Q(Q>0)的反应速率随时间变化如图所示,在t1、t3、t4、t5时刻都只有一种因素发生改变,下列判断正确的是( )
反应3A(g)?2B(g)+C(g)+Q(Q>0)的反应速率随时间变化如图所示,在t1、t3、t4、t5时刻都只有一种因素发生改变,下列判断正确的是( )
 反应3A(g)?2B(g)+C(g)+Q(Q>0)的反应速率随时间变化如图所示,在t1、t3、t4、t5时刻都只有一种因素发生改变,下列判断正确的是( )
反应3A(g)?2B(g)+C(g)+Q(Q>0)的反应速率随时间变化如图所示,在t1、t3、t4、t5时刻都只有一种因素发生改变,下列判断正确的是( )| A. | t6~t7阶段,C的百分含量最大 | |
| B. | t2~t3阶段,A的转化率最小 | |
| C. | t3时刻,改变因素一定是使用了催化剂 | |
| D. | t5时刻,改变因素一定是升高了温度 |
16.要除去下表所列有机物中的杂质(括号内为杂质),从(1)中选择适宜的试剂,从(2)中选择分离提纯的方法,用序号填入表中.
(1)试剂:a.溴水 b.氢氧化钠溶液 c.碳酸钠溶液 d.生石灰 e.酸性高锰酸钾溶液
(2)方法:A.过滤 B.分液 C.蒸馏 D.洗气
(1)试剂:a.溴水 b.氢氧化钠溶液 c.碳酸钠溶液 d.生石灰 e.酸性高锰酸钾溶液
(2)方法:A.过滤 B.分液 C.蒸馏 D.洗气
| 要提纯的物质 (杂质) | 乙烷 (乙烯) | 乙酸乙酯 (乙酸) | 乙醇 (水) | 溴苯 (溴) |
| 选用试剂 | ||||
| 分离方法 |
3.下列所述变化规律正确的是( )
| A. | Na、Mg、Al还原性依次增强 | |
| B. | HCl、H2S、PH3稳定性依次减弱 | |
| C. | NaOH、KOH、Mg(OH)2碱性依次增强 | |
| D. | S2-、Cl-、K+、Ca2+离子半径依次增大 |
13.若NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 13g乙炔(C2H2)总原子数为2NA | |
| B. | 4℃时9mL水和11.2L氮气含有相同的分子数 | |
| C. | 同温同压下,NA个NO2与NA个N2的体积相等 | |
| D. | 标准状况下,11.2 L氧气所含的原子数目为NA |
17.下列反应中,反应后固体物质增重的是( )
| A. | 氢气通过灼热的CuO粉末 | B. | 二氧化碳通过Na2O2粉末 | ||
| C. | CO高温下还原Fe2O3 | D. | 将锌粒投入Cu(NO3)2溶液 |
18.在密闭容器中合成氨反应:N2(g)+3H2(g)?2NH3(g),在下列情况下,不能使反应速度加快的是( )
| A. | 加入氮气 | B. | 扩大容器体积,减小压强 | ||
| C. | 加入适量催化剂 | D. | 适当升高温度 |
 .
. ,该反应属于取代反应类型.
,该反应属于取代反应类型.